
10.(09年北京理综·27)(14分)
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。


可选药品:浓硝酸、3 mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应。
2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)实验应避免有害气体排放到空气中。装置③、④、⑥中盛放的药品依次是
。
(2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品,打开弹簧夹后
 。
。
(3)装置①中发生反应的化学方程式是  。
。
(4)装置②的作用是
,发生反应的化学方程式是
。
(5)该小组得出的结论所依据的实验现象是 。
(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液 中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)
。
a.加热该绿色溶液,观察颜色变化
b.加水稀释该绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通人浓硝酸与铜反应产生的气体,观察颜色变化
答案:(14分)(1)3mol·L-1稀硝酸、浓硝酸、氢氧化钠溶液(2)通入CO2 一段时间,关闭弹簧夹,将装置⑤中的导管末端伸入倒置的烧瓶内(3)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O(4)将NO2 转化为NO 3NO3+H2O=2HNO3+NO(5)装置③中液面上方气体仍为无色,装置④中液面上方气体有无色变为红棕色(6)acd
9.(09年广东化学·23)(11分)
磷单质及其化合物的、有广泛应用。
(1)同磷灰石[主要成分]在高温下制备黄磷(P4)的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)
; H
H
①上述反应中,副产物矿渣可用来 。
②已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)=6Cas3(PO4)2(s)+2CaSio3(s)+SiF4(g) ;△H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g);△H2
SiO2(s)+CaO(s)=CaSiO3(s) ;△H3
 用△H1、△H2和△H3表示
用△H1、△H2和△H3表示 H,
H, H=
。
H=
。
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式见右图)之间脱去两个水分子产物,其结构式为 。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为 。
(3)次磷酸钠(NaH2PO2)可用于化学镀镍。
①NaH2PO2中P元素的化合价为 。
②化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a) Ni2+ + H2PO2-+ → Ni++ H2PO3-+
(b)6H2PO-2 +2H+ =2P+4H2PO3+3H2↑
请在答题卡上写出并配平反应式(a)。
③利用②中反应可在塑料镀件表面沉积镍-磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
方法上的不同点: ;原理上的不同点: ;化学镀的优点: 。
答案:(1)水泥;△H1-3△H2+18△H3(2) ,Na5P3O10,(3)+1;2Ni2+
+ 1H2PO2-+
1H2O → 2 Ni+ +1H2PO3-+
2 H+(4)化学镀中镀件直接与电解质溶液接触反应;电镀通过外加电流,在镀件外形成镀层 ;化学镀是利用化学腐蚀反应;电镀是利用电解池,外加电流进行氧化还原反应 ; 装置简便,节约能源,操作简便 。
,Na5P3O10,(3)+1;2Ni2+
+ 1H2PO2-+
1H2O → 2 Ni+ +1H2PO3-+
2 H+(4)化学镀中镀件直接与电解质溶液接触反应;电镀通过外加电流,在镀件外形成镀层 ;化学镀是利用化学腐蚀反应;电镀是利用电解池,外加电流进行氧化还原反应 ; 装置简便,节约能源,操作简便 。
8. (09年海南化学·20.4)(11分)
(09年海南化学·20.4)(11分)
 工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。请回答下列问题:
工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。请回答下列问题:
 (1)氨催化氧化的化学方程式为
:
(1)氨催化氧化的化学方程式为
:
 (2)原料气中空气必须过量,其主要原因是
;
(2)原料气中空气必须过量,其主要原因是
;
 (3)将铂铑合金做成薄丝网的主要原因是
;
(3)将铂铑合金做成薄丝网的主要原因是
;
 (4)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为
,为了提高水对二氧化氮的吸收率,可采取的措施为
(答2项)。
(4)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为
,为了提高水对二氧化氮的吸收率,可采取的措施为
(答2项)。
答案:(11分)
(1)4NH3+5O2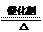 4NO+6H2O
4NO+6H2O (3分)
(3分)
 (2)提高氨的转化率和一氧化氮的转化率(2分)
(2)提高氨的转化率和一氧化氮的转化率(2分)
 (3)增大单位质量的催化剂与反应物的接触面积(2分)
(3)增大单位质量的催化剂与反应物的接触面积(2分)
 (4)3NO2+H2O=2HNO3+NO 加压 降温(4分)
(4)3NO2+H2O=2HNO3+NO 加压 降温(4分)
7.(09年全国理综Ⅱ·28)(15分)
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。

回答下列问题:
(1)A中加入的物质是 ,
发生反应的化学方程式是 。
(2)B中加入的物质是 ,其作用是 。
(3)实验时在C中观察到得现象是 ,发生反应的化学方程式是 。
(4)实验时在D中观察到得现象是 ,D中收集到的物质是 ,检验该物质的方法和现象是 。
答案:(15分)(1)固体NH4Cl和Ca(OH)2 2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O(其他合理答案也给分)
CaCl2+2NH3↑+2H2O(其他合理答案也给分)
(2)碱石灰(或CaO) 除去NH3气流中的水汽
(3)黑色粉末部分逐渐变为红色 2NH3+3CuO N2+3H2O+3Cu
N2+3H2O+3Cu
(4)出现无色液体 氨水 用红色石蕊试纸检验、试纸变蓝 用无水硫酸铜检验、无水硫酸铜变蓝
6.
 (09年上海化学·31)烟气中NOx是NO和NO2的混合物(不含N2O4)。
(09年上海化学·31)烟气中NOx是NO和NO2的混合物(不含N2O4)。
 (1)根据废气排放标准,1m3烟气最高允许含400mgNOx。若NOx中NO质量分数为0.85,则1m3烟气中最高允许含NO
L(标准状况,保留2位小数)。
(1)根据废气排放标准,1m3烟气最高允许含400mgNOx。若NOx中NO质量分数为0.85,则1m3烟气中最高允许含NO
L(标准状况,保留2位小数)。
 (2)工业上通常用溶质质量分数为0.150的Na2CO3水溶液(密度1.16g/mL)作为NOx吸收剂,该碳酸钠溶液物质的量浓度为
mol/L(保留2位小数)。
(2)工业上通常用溶质质量分数为0.150的Na2CO3水溶液(密度1.16g/mL)作为NOx吸收剂,该碳酸钠溶液物质的量浓度为
mol/L(保留2位小数)。
 (3)已知:NO+NO2+Na2CO3=2NaNO2+CO2 ①
(3)已知:NO+NO2+Na2CO3=2NaNO2+CO2 ①
 2NO2+Na2CO3=NaNO2+NaNO3+CO2 ②
2NO2+Na2CO3=NaNO2+NaNO3+CO2 ②
1m3 含2000mgNOx的烟气用质量分数为0.150的碳酸钠溶液吸收。若吸收率为80%,吸收后的烟气
排放标准(填“符合”或“不符合”),理由:
。
含2000mgNOx的烟气用质量分数为0.150的碳酸钠溶液吸收。若吸收率为80%,吸收后的烟气
排放标准(填“符合”或“不符合”),理由:
。
 (4)加入硝酸可改变烟气中NO和NO2的比,反应为:
(4)加入硝酸可改变烟气中NO和NO2的比,反应为: NO+2HNO3=3NO2+H2O
NO+2HNO3=3NO2+H2O
 当烟气中n(NO)︰n(NO2)=2︰3时,吸收率最高。
当烟气中n(NO)︰n(NO2)=2︰3时,吸收率最高。
 1m3烟气含2000mgNOx,其中n(NO)︰n(NO2)=9︰1。
1m3烟气含2000mgNOx,其中n(NO)︰n(NO2)=9︰1。
 计算:(i)为了达到最高吸收率,1m3烟气需用硝酸的物质的量(保留3位小数)。
计算:(i)为了达到最高吸收率,1m3烟气需用硝酸的物质的量(保留3位小数)。
 (ii)1m3烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应中,反应①比反应②迅速。计算结果保留1位小数)。
(ii)1m3烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应中,反应①比反应②迅速。计算结果保留1位小数)。
答案:(本题共11分)
 (1)0.25i
(1)0.25i
 (2)1.64
(2)1.64
 (3)不符合 因吸收后烟气总体积减小,NOx含量仍超过
(3)不符合 因吸收后烟气总体积减小,NOx含量仍超过
 (4)(i)
(4)(i) n(NO)=0.057mol
n(NO)=0.057mol
 NO+2HNO3=3NO2+H2O
NO+2HNO3=3NO2+H2O






 n(HNO3)=2x=0.035mol
n(HNO3)=2x=0.035mol
 (ii)
(ii)


5.(09年重庆理综·9)下列叙述正确的是
A.SO2具有还原性,故可作漂白剂
B.Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg
C.浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色
D.Fe在Cl2中燃烧生成FeCl3,故在与其它非金属反应的产物中的Fe也显+3价
答案:C
4.(09年上海化学·4)用浓氯化铵溶液处理过的舞台幕布不易着火。其原因是
①幕布的着火点升高 ②幕布的质量增加
③氯化铵分解吸收热量,降低了温度 ④氯化铵分解产生的气体隔绝了空气
A.①② B.③④ C.③④ D.②④
答案:B
3.(09年全国理综Ⅱ·6)物质的量之比为2︰5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
A.1︰4 B.1︰5 C.2︰3 D.2︰5
 答案:A
答案:A
2.(09年宁夏理综·7)将22.4L某气态氮氧化合物与足量的灼热铜粉完全反应后,气体体积11.2L(体积均在相同条件下测定),则该氮氧化合物的化学式为
A.NO2 B.N2O2 C.N2O D.N2O4
答案:A
13.(09年北京理综·28)(15分)
以黄铁矿为原料生产硫酸的工艺流程图如下:

(1)将燃烧黄铁矿的化学方程式补充完整
4 +11O2 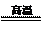 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)接触室中发生反应的化学方程式是 。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母) 。
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)每160 g SO3气体与H2O化合放出260.6 kJ的热量,该反应的热化学方程式是
。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2 和铵盐。
① SO2 既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2 吸收Br2的离子方程式是 。
②为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00 mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解),该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果:
铵盐质量为10.00 g和20.00 g时,浓硫酸增加的质量相同;铵盐质量为30.00 g时,浓硫酸增加的质量为0.68 g;铵盐质量为40.00 g时,浓硫酸的质量不变。
计算:该铵盐中氮元素的质量分数是 %;若铵盐质量为l5.00 g,浓硫酸增加的质量为 。(计算结果保留两位小数)
答案:(15分)(1)FeS2 (2)2SO2+O2 2SO3
2SO3
(3)abd(4)SO3(g)+H2O(l)=H2SO4(l)△H=-130.3kJ·mol-1
(5)①SO2+Br2+2H2O=4H++2Br-+SO42- ②14.56 2.31g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com