
6.(09上海卷 10)9.2g金属钠投入到足量的重水中,则产生的气体中含有
10)9.2g金属钠投入到足量的重水中,则产生的气体中含有
 A.0.2mol中子
B.0.4mol电子
A.0.2mol中子
B.0.4mol电子
 C.0.2mol质子
D.0.4mol分子
C.0.2mol质子
D.0.4mol分子
5.(09福建卷 10)
在一定条件下,Na2CO3溶液存在水解平衡:
10)
在一定条件下,Na2CO3溶液存在水解平衡: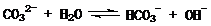 。下列说法正确的是
。下列说法正确的是
 A. 稀释溶液,水解平衡常数增大
A. 稀释溶液,水解平衡常数增大
B. 通入CO2,平衡朝正反应方向移动
C. 升高温度, 减小
减小
D. 加入NaOH固体,溶液PH减小
4.(09浙江卷 12)市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li
12)市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li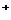 的高分子材料。这种锂离子电池的电池反应为:
的高分子材料。这种锂离子电池的电池反应为:
 Li+2Li
Li+2Li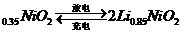
 下列说法不正确的是
下列说法不正确的是
 A.放电时,负极的电极反应式:Li-e
A.放电时,负极的电极反应式:Li-e =Li
=Li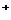
 B.充电时,Li
B.充电时,Li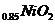 既发生氧化反应又发生还原反应
既发生氧化反应又发生还原反应
 C.该电池不能用水溶液作为电解质
C.该电池不能用水溶液作为电解质
 D.放电过程中Li
D.放电过程中Li 向负极移动
向负极移动
3.(09天津卷 2) 25 ℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是
2) 25 ℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是
 A.均存在电离平衡和水解平衡
A.均存在电离平衡和水解平衡
 B.存在的粒子种类相同
B.存在的粒子种类相同
 C.c(OH-)前者大于后者
C.c(OH-)前者大于后者
 D.分别加入NaOH固体,恢复到原温度,c(CO33-)均增大
D.分别加入NaOH固体,恢复到原温度,c(CO33-)均增大
2.(09全国卷Ⅱ
 8)下列叙述中正确的是
8)下列叙述中正确的是 21世纪教育网
21世纪教育网

 A. 向含有CaCO3沉淀的水中通入CO2 至沉淀恰好溶解,再向溶液中加入NaHCO3 饱
A. 向含有CaCO3沉淀的水中通入CO2 至沉淀恰好溶解,再向溶液中加入NaHCO3 饱
 和溶液,又有CaCO3沉淀生成
和溶液,又有CaCO3沉淀生成

 B. 向Na2 CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2 CO3的物质的量之比为1:2.
B. 向Na2 CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2 CO3的物质的量之比为1:2.

 C. 等质量的NaHCO3和Na2 CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
C. 等质量的NaHCO3和Na2 CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同

 D. 向Na2 CO3饱和溶液中通入CO2,有NaHCO3结晶析出
D. 向Na2 CO3饱和溶液中通入CO2,有NaHCO3结晶析出
1.(09全国卷Ⅰ11)为了检验某含有 杂质的
杂质的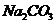 样品的纯度,现将
样品的纯度,现将 克样品加热,其质量变为
克样品加热,其质量变为 g,,则该样品的纯度(质量分数)是
g,,则该样品的纯度(质量分数)是
A.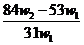
B.
C.
D.
11.(07年高考海南化学卷·29)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:__________________________________;
(2)写出“联合制碱法”有关反应的化学方程式:___________________________________;______________________________________。
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?__________________________________________________________________________;
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:原子利用率(%) =_____________________________________。
[答案](1)2NH4Cl+Ca(OH)2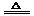 2NH3↑+CaCl2+2H2O。
2NH3↑+CaCl2+2H2O。
(2)NH3+CO2+H2O+NaCl(饱和) = NaHCO3↓+NH4Cl; 2NaHCO3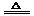 Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
(3)“氨碱法”的CO2来源于石灰石煅烧,“联合制碱法”的CO2来源于合成氨工业的废气。
(4)由于总反应可看作是:2NH3+2NaCl+CO2+H2O = Na2CO3+2NH4Cl,所以:
原子利用率(%) =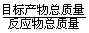 ×100% =
×100% =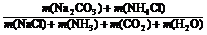 ×100%;
×100%;
2009年高考化学试题分类汇编--碱金属及其化合物
10.(07年高考上海化学卷·31)钾是活泼的碱金属,钾和氧有氧化钾(K2O)、过氧化钾(K2O2)和超氧化钾(KO2)等多种化合物。
(1)钾和硝酸钾反应可制得K2O(10K+2KNO3 = 6K2O+N2),39.0 g钾与10.1 g硝酸钾充分反应生成K2O的质量为__ g。
(2)某过氧化钾样品中氧的质量分数(杂质不含氧)为0.28,则样品中K2O2的质量分数为 。
(3)超氧化钾和二氧化碳反应生成氧气(4KO2+2CO2 = 2K2CO3+3O2),在医院、矿井、潜水、高空飞行中用作供氧剂。13.2 L(标准状况)CO2和KO2反应后,气体体积变为18.8 L (标准状况),计算反应消耗的KO2的质量。
(4)KO2加热至600 ℃部分分解得到产物A。6.30 g产物A充分吸收二氧化碳生成碳酸钾并产生氧气1.12 L(标准状况),试确定产物A中钾氧两种原子个数之比。如果产物A只含有两种化合物,写出所有可能的化学式并计算A中两种化合物的物质的量之比。
[答案](1)28.2 g。 (2)96.25%。 (3)71 g。
(4) KxOy+x/2CO2 = x/2K2CO3+(y-0.5x)/2O2
 =
= 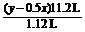
解得x:y=2:3,即n(K):n(O)=2:3。(合理即给分)
即得化学式为:n(KO2):n(K2O2) = 2:1,n(KO2):n(K2O) = 4:1。
9.(07年高考江苏卷·24)(8分)在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除去氧化膜、并用针刺一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器中仅收集到1.12 L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27 g,水槽和容器内溶液的总体积为2.0 L,溶液中NaOH的浓度为0.050 mol·L-1(忽略溶液中离子的水解和溶解的氢气的量)。
(1)写出该实验中发生反应的化学方程式。
(2)试通过计算确定该钠块中钠元素的质量分数。
[答案](1)Na2O+H2O = 2NaOH, 2Na+2H2O = 2NaOH+H2↑, 2Al+2NaOH+2H2O = 2NaAlO2+3H2↑。
(2)n(NaOH余) = 2.0 L×0.05 mol·L-1 = 0.1 mol,
n(H2) = =0.05 mol,n(Al) =
=0.05 mol,n(Al) = = 0.01 mol = n(NaAlO2),
= 0.01 mol = n(NaAlO2),
由电子守恒知:n(Na)+3n(Al) = 2n(H2),即:n(Na)+3×0.01 mol = 2×0.05 mol,得:n(Na) = 0.07 mol。
由钠守恒知:n(NaAlO2)+n(NaOH) = n(Na)+2n(Na2O),即:0.01 mol+0.1 mol = 0.07 mol+2n(Na2O),
得:n(Na2O) = 0.02 mol。
w (Na) =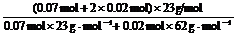 ≈89%。
≈89%。
3.(1)0.012mol (2)8 (3)n(OH-)︰n(CO32-)=16︰1 (4)Al2Mg6(OH) 16CO3·4H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com