
5.答案:B 21世纪教育网
21世纪教育网
解析:平衡常数仅与温度有关,故稀释时是不变的,A项错;CO2通入水中,相当于生成H2CO3,可以与OH-反应,而促进平衡正向移动,B项正确;升温,促进水解,平衡正向移动,故表达式的结果是增大的,C项错;D项,加入NaOH,碱性肯定增强,pH增大,故错。
4.
 答案:D
答案:D 21世纪教育网
21世纪教育网
 解析:
解析:
A项, Li从零价升至正价,失去电子,作为负极,正确;
B项, 反应逆向进行时。反应物只有一种,故化合价既有升,又有降,所以既发
生氧化反应又发生还原反应,正确;
C项, 由于Li可以与水反应,故应为非水材料,正确;
D项,原电池中阳离子应迁移至正极失电子,故错。
3.

 答案:C
答案:C
 解析:
解析:
相同浓度时,Na2CO3的碱性强于NaHCO3,C项错。
2.
 答案:D
答案:D
 解析:
解析:
CaCO3与CO2反应生成Ca(HCO3)2,再加入NaHCO3是没有现象的,A项错;
向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,仅生成NaHCO3,无CO2气体放出,B项错;
等质量的NaHCO3和Na2CO3,其中NaHCO3的物质的量多,与足量HCl反应时,放出的CO2多,C项错;
D项,发生的反应为:Na2CO3 + CO2 + H2O =2NaHCO3↓,由于NaHCO3的溶解性较小,故有结晶析出,正确。
1.答案:A
解析:
2NaHCO3 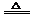 Na2CO3 + CO2↑ + H2O m
(减少)
Na2CO3 + CO2↑ + H2O m
(减少)
2×84 106 62
x (W1- w2)
解得x=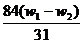 ,将其带入下式可得: w(Na2CO3)= (w1- x )/W1 =
,将其带入下式可得: w(Na2CO3)= (w1- x )/W1 = 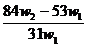 ,A项正确。
,A项正确。
11.(09宁夏卷 27)(15分)下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略。)
27)(15分)下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略。)
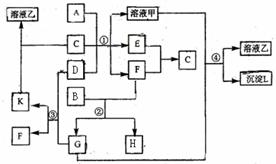




 (1)A、B、C、D代表的物质分别为 、 、
、 (填化学式);
(1)A、B、C、D代表的物质分别为 、 、
、 (填化学式);
 (2)反应①中的C、D均过量,该反应的化学方程式是 ;
(2)反应①中的C、D均过量,该反应的化学方程式是 ;
 (3)反应②中,若B与F物质的量之比为4∶3,G、H分别是 、 (填化学式);
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是 、 (填化学式);
 (4)反应③产物中K的化学式为 ;
(4)反应③产物中K的化学式为 ;
 (5)反应④的离子方程式为 。
(5)反应④的离子方程式为 。
10.(09海南卷 15)(9分)
15)(9分)
 Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2
= 4LiCl +S +SO2。
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2
= 4LiCl +S +SO2。
 请回答下列问题:
请回答下列问题:
 (1)电池的负极材料为
,发生的电极反应为
;
(1)电池的负极材料为
,发生的电极反应为
;
 (2)电池正极发生的电极反应为 ;
(2)电池正极发生的电极反应为 ;
 (3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。
如果把少量水滴到SOCl2中,实验现象是
,反应的化学方程式为
;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。
如果把少量水滴到SOCl2中,实验现象是
,反应的化学方程式为
;
 (4)组装该电池必须在无水、无氧的条件下进行,原因是
。
(4)组装该电池必须在无水、无氧的条件下进行,原因是
。
9.(09四川卷29)(15分)
新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
方法一:将碳酸锂、乙酸亚铁[(CH3COO)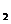 Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
在锂郭了电池中,需要一种有机聚合物作为正负极之间锂郭子选移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下:
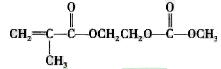
请回答下列问题:
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原是 。
(2)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有 、 、 (填化学式)生成。
(3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为
。
(4)写出M与足量氧化钠溶液反应的化学方程式:
。
(5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为
。
8.(09天津卷 10)(14分)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
10)(14分)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:

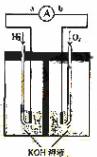 (1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为
 (用a、b 表示)。
(用a、b 表示)。
 (2)负极反应式为 。
(2)负极反应式为 。
 (3)电极表面镀铂粉的原因为
。
(3)电极表面镀铂粉的原因为
。
 (4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
 Ⅰ.2Li+H2
Ⅰ.2Li+H2
 2LIH
2LIH
 Ⅱ.LiH+H2O==LiOH+H2↑
Ⅱ.LiH+H2O==LiOH+H2↑
 ①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
 ②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
 ③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为
mol。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为
mol。
7.(09海南卷3)除去NaHCO3溶液中混有的少量Na2CO3可采取的方法是:
A.通入二氧化碳气体 B.加入氢氧化钡溶液
C.加入澄清石灰水 D.加入稀盐酸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com