
4.如图12-1-12所示,绝缘水平面上有两个离得很近的导体环a、b.将条形磁铁沿它们的正中向下移动(不到达该平面),a、b将如何移动( )
A.a、b将相互远离
B.a、b将相互靠近
 C.a、b将不动
C.a、b将不动
D.无法判断
解析:选A.根据Φ=BS,磁铁向下移动过程中B增大,所以穿过每个环中的磁通量都有增大的趋势.由于S不可改变,为阻碍增大,导体环应该尽量远离磁铁,所以a、b将相互远离.
3.(2009年淄博模拟)直导线ab放在如图12-1-11所示的水平导体框架上,构成一个闭合回路.长直导线cd和框架处在同一个平面内,且cd和ab平行,当cd中通有电流时,发现ab向左滑动.关于cd中的电流下列说法正确的是( )
A.电流肯定在增大,不论电流是什么方向
B.电流肯定在减小,不论电流是什么方向
C.电流大小恒定,方向由c到d
D.电流大小恒定,方向由d到c
 解析:选B.ab向左滑动,说明通过回路的磁通量在减小,通过回路的磁感应强度在减弱,通过cd的电流在减小,与电流方向无关.
解析:选B.ab向左滑动,说明通过回路的磁通量在减小,通过回路的磁感应强度在减弱,通过cd的电流在减小,与电流方向无关.
2.(2008年高考海南卷)一航天飞机下有一细金属杆,杆指向地心,若仅考虑地磁场的影响,则当航天飞机位于赤道上空( )
A.由东向西水平飞行时,金属杆中感应电动势的方向一定由上向下
B.由西向东水平飞行时,金属杆中感应电动势的方向一定由上向下
C.沿经过地磁极的那条经线由南向北水平飞行时,金属杆中感应电动势的方向一定由下向上
D.沿经过地磁极的那条经线由北向南水平飞行时,金属杆中一定没有感应电动势
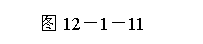
 解析:选AD.赤道上方的地磁场方向是由南指向北,根据右手定则,杆由东向西水平飞行时,下端电势高,故A对、B错.若杆沿经线由南向北或由北向南水平飞行时,杆均不切割磁感线,杆中不会产生感应电动势,故C错、D正确.
解析:选AD.赤道上方的地磁场方向是由南指向北,根据右手定则,杆由东向西水平飞行时,下端电势高,故A对、B错.若杆沿经线由南向北或由北向南水平飞行时,杆均不切割磁感线,杆中不会产生感应电动势,故C错、D正确.
1.(2009年广东中山模拟)我国已经制定了登月计划,假如航天员登月后想探测一下月球表面是否有磁场,他手边有一只灵敏电流表和一个小线圈.则下列推断中正确的是( )
A.直接将电流表放于月球表面,看是否有示数来判断磁场有无
B.将电流表与线圈组成闭合电路,使线圈沿某一方向运动,若电流表无示数,则判断月球表面无磁场
C.将电流表与线圈组成闭合电路,使线圈沿某一方向运动,若电流表有示数,则判断月球表面有磁场
D.将电流表与线圈组成闭合电路,使线圈分别绕两个互相垂直的轴转动,月球表面若有磁场,则电流表至少有一次示数不为零
答案:CD
7.Cl2+H2O=HCl+HclO 8.Cl2+2NaOH=NaCl+NaClO+H2O
5.2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O 6.2HClO=2HCl+O2↑
3. 2KClO3 2KCl+3O2↑ 4.Fe+Cu2+=Fe2++Cu
化学反应有多种分类方法。
氧化反应与还原反应必定同时发生,称为氧化还原反应,
(1)物质所含元素化合价升高的反应是氧化反应;物质所含元素化合价降低的反应是还原反应。
(2)有元素化合价升降的化学反应是氧化还原反应(化合价升降角度)
(练习)用化合价升降观点分析下列反应的氧化还原情况:

(1)2KClO3 2KCl+3O2↑
(2)2KMnO4 K2MnO4+MnO2+O2↑
(3)MnO2+4HCl MnCl2+Cl2↑+2H2O
有化合价升降的反应都是氧化还原反应
还原剂--升--失--氧
氧化剂--降--得--还
(讨论)基本反应类型与氧化还原反应的关系
问:氧化还原反应和四大基本反应类型有什么关系?是不是有哪种肯定是氧化还原反应,哪种肯定不是,或者不一定呢?
总结 一定是氧化还原反应, 一定不是氧化还原反应, 不一定是氧化还原反应。
思考:有单质参加的化学反应一定是氧化还原反应吗?




 (结论)
(结论)

练习:
用化合价升降观点分析下列氧化还原反应,写出双线桥.
1.C+2H2SO4(浓) CO2↑+2SO2↑+2H2O 2.2SO2+O2=2SO3

(七)、离子方程式的意义
不仅可表示某一个具体的化学反应,而且可表示所有同一类型的离子反应。
[归纳与整理]
复分解反应型离子反应发生的条件:
[练习]6、写出下列离子方程式
1、HCl与NaOH溶液
2、Al与HCl
3、Al2O3与盐酸
4、HCl与NaCO3溶液(离子)
5、Ca(OH)2与NaCO3(离子)
6、AgNO3与NaCl(离子)
7、Fe与FeCl3(离子)
8、FeCl3与Cu(离子)
9.BaCl2(aq)+H2SO4(aq)
10.Ba(OH)2(aq)+H2SO4(aq)
11.Ba(OH)2(aq)+CuSO4(aq)
12. CaCO3+足量HCl(aq)
13 CaCO3+醋酸
14 氧化铁与盐酸
教学目标
6、 了解氧化还原反应的概念、特征及判断;
7、 理解氧化剂、还原剂,被氧化、被还原的概念;
教学重点。难点:氧化还原反应的概念、特征及判断;
被氧化、被还原的概念
教学过程:
(六)、离子方程式的书写步骤:
1.写 写出反应方程式
2.拆 易电离的物质
3.删 没参加反应的离子
4.查 检查两个守恒
2.难溶物、弱酸、弱碱、H2O、气体、单质、氧化物等仍用化学式表示.
(在讲述时进行举例说明。例如,难溶物:BaCO3、 CaCO3 、Fe(OH)3;难电离物质:H2O 弱酸 弱碱 ;气体:CO2、 SO2 、SO3 ;单质:H2、 Cl2、 Fe 、Cu ;氧化物:NaO CaO )
3.在检查时注意两个守恒:电子守恒和电荷守恒。
[练习]5、
1.完成下列反应的离子方程式:
① HCl+NaOH ②H2SO4+KOH ③HNO3+Ba(OH)2
2.有什么发现?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com