
14.
将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500 mL 2 mol/L NaOH溶液完全吸收,生成的盐溶液中NaNO3的物质的量为(已知:2NO2+2NaOH=NaNO2+NaNO3+H2O
,NO+NO2+2NaOH
=2NaNO2+H2O。)
A.0.2 mol B. 0.4 mol C.0.6 mol D. 0.8 mol

非 选 择 题(共72分)
13. 下列溶液中微粒的物质的量浓度关系正确的是
A.NaHCO3溶液中:

B.pH=3的CH3COOH与pH=11的NaOH溶液等体积混合后的溶液中:c(H+)>c(OH-)
C.0.1 mol/L的NH4Cl溶液中: >
> >
> >
>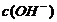

D.物质的量浓度相等的CH3COOH
和CH3COONa溶液等体积混合后的溶液中:
2c(Na+)=c(CH3COOH)+c(CH3COO-) 
12. 科学家P.Tatapudi等人首先使用在空气中电解水(酸性条件下)的方法,阳极制得臭氧,阴极制得过氧化氢。电解总方程式为:3H2O+3O2 3H2O2+O3,下列说法正确的是
3H2O2+O3,下列说法正确的是

A.阴极反应:3O2+6H2O+6e-=3H2O2+6OH- 
B.阳极反应:3H2O-6e-= O3+6H+
C.每生成标准状况下22.4 L O3转移电子数为3 moL 
D.电解一段时间后,溶液pH不变
11. 下列离子方程式与所述事实相符且正确的是
A.0.5
mol/L NaHSO4与0.5 mol/L Ba(OH)2混合至溶液呈中性:
Ba2++OH-+SO42-+H+=BaSO4↓+H2O
B.向2
mol/L Fe(NO3)2(aq)中滴加少量氢碘酸:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
C.向20
mL 0.5 mol/L FeBr2(aq)中通入224 mL Cl2(标准状况):
2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
D.向30
mL 0.5 mol/L NaOH(aq)中通入224 mL CO2(标准状况):
3OH-+2CO2=CO32-+HCO3-+H2O
10. 为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是
|
|
被提纯的物质 |
除杂试剂 |
分离方法 |
|
A |
溴化钠溶液(NaI) |
氯水、CCl4 |
萃取、分液 |
|
B |
氯化铵溶液(FeCl3) |
氢氧化钠溶液 |
过滤 |
|
C |
CO(O2) |
铜网 |
通过灼热铜丝网 |
|
D |
苯(苯酚) |
NaOH溶液 |
分液 |
9. 下列化学实验事实及其解释都正确的是
下列化学实验事实及其解释都正确的是
A.
将饱和氯水滴到淀粉碘化钾试纸上出现如图现象,说明低浓度氯水能将I-氧化成I2,高浓度氯水能将I2进一步氧化成碘的化合物
B.
将过量CO2通入Ca(ClO)2溶液得澄清溶液,说明H2CO3的酸性比HClO弱
C.
用饱和Na2CO3溶液可将BaSO4转化为BaCO3,说明Ksp(BaSO4)>Ksp(BaCO3)
D.
铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝膜熔点高
8. X、Y、Z、W是原子序数依次增大的短周期元素,且均在不同族,其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。下列说法错误的是
A.原子半径:Y>Z>W
B.YW3水溶液蒸干可得YW3固体
C.XW2熔点为-107℃,沸点为12.5℃,说明固态XW2为分子晶体
D.ZW2分子结构为 ,说明ZW2是极性分子
,说明ZW2是极性分子
7. 下列各组离子在溶液中大量共存,且加入(NH4)2Fe(SO4)2·6H2O晶体后仍能大量存在的是
A.Na+、H+、Cl-、NO3- B.K+、Ba2+、OH-、I-
C.Na+、Mg2+、Cl-、SO42- D.Cu2+、S2-、Br-、ClO-
6. 下列有关实验操作的叙述正确的是
下列有关实验操作的叙述正确的是
A.
用pH试纸粗略测定饱和氯水的pH
B.
用12 mol/L的浓硝酸配制1.00 mol/L-1的稀硝酸
C.
将95%的工业酒精直接蒸馏可制成无水乙醇
D.
用右图装置实验,可观察无色NO与红棕色NO2的转化 
5. 对下列工业生产应用的解释正确的是 
A.电解饱和食盐水过程中使用离子交换膜,可以使OH-自由通过
B.电解Al2O3过程中加入冰晶石(Na3AlF6)作催化剂
C.由于MgO熔点很高,工业上不用电解MgO的方法制备镁
D.由于合成氨反应吸热,生产需在高温下进行
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com