
3.下列文字表述与反应方程式对应且正确的是
A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+==AgBr↓
B.用醋酸除去水垢:CaCO3
+ 2H+==Ca2+ + H2O + CO2↑
C.利用腐蚀法制作印刷线路板:Fe3+
+ Cu == Fe2+ + Cu2+
D.实验室用液溴和苯在催化剂作用下制溴苯: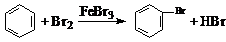

2.判断下列有关化学基本概念的依据正确的是 
A.氧化还原反应:元素化合价是否变化 
B.共价化合物:是否含有共价键
C.强弱电解质:溶液的导电能力大小 
D.金属晶体:晶体是否能够导电
1.下列行为违背“环境友好和可持续发展”战略的是
A.我国内蒙的煤田正在进行将煤液化汽化,同时对产品进行综合利用的研究
B.南京某大学的研究所正在进行的以植物秸秆为原料制生物柴油的研究
C.2008年初我国南方大面积的暴雪造成严重灾害,为了加快因灾导致瘫痪的高速公路的快速恢复,在高速路面大范围的使用了溶雪剂
D.某化工厂正在进行以“设计绿色化工工艺,提高原子利用率”为目标的产业换代

21. (10分)固体碘在水中溶解度很小,实验室配制较浓的“碘水”时常将固体碘溶于一定浓度的KI溶液中。已知:I2与KI溶液发生如下反应:I2(aq)+I¯(aq)  I3¯(aq),该反应平衡常数随温度升高而减小。
I3¯(aq),该反应平衡常数随温度升高而减小。
(1)下列有关说法正确的是 ▲ 。
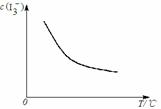 A.反应:I2(aq)+I¯(aq)
A.反应:I2(aq)+I¯(aq)  I3¯(aq)的△H
>0
I3¯(aq)的△H
>0
B. I3¯的平衡浓度[c(I3¯)]与温度T的关系如右图
C.在I2的KI水溶液中加入少量的NaOH(s)或FeCl3(s)均可使溶液中c(I3¯)减小
D.依此原理, Cl2在一定浓度的NaCl溶液中溶解度增大
(2)t℃时,将0.850 mol KI固体和0.820 mol 固体I2溶于水配成1000 mL KI-I2的水溶液,经测定该溶液中c(I2)= 0.0200 mol·L-1。
①t℃时,计算反应I2(aq)+I¯(aq)  I3¯(aq)的平衡常数K(要求写出计算过程)。
I3¯(aq)的平衡常数K(要求写出计算过程)。
▲
②已知:2Na2S2O3+I2=Na2S4O6+2NaI。若取上述所配溶液2.0 mL于锥形瓶中加水稀释后,再加两滴淀粉溶液,然后用0.100 mol·L-1 Na2S2O3标准溶液进行滴定,计算滴定终点时所消耗的Na2S2O3标准溶液的体积(要求写出计算过程)。
20.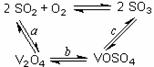 (10分)工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收。请回答下列各问题:
(10分)工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收。请回答下列各问题:
(1)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如图)。其中过程a的化学方程式可表示为 ▲ 。
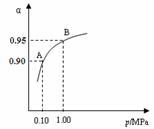 (2)一定温度时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如右图所示。A与B表示不同压强下的SO2转化率,通常情况下工业生产中
(2)一定温度时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如右图所示。A与B表示不同压强下的SO2转化率,通常情况下工业生产中
采用常压的原因是 ▲ 。
(3)下列有关硫酸工业生产的说法正确的是(填字母序号) ▲ 。
A.粉碎黄铁矿使其充分燃烧
B.过量空气能提高SO2的转化率
C.吸收塔中使用稀硫酸自上而下逆向吸收SO3
D.沸腾炉排出的矿渣可供炼铁
(4)硫酸工业的尾气与氨水反应所得到的高浓度溶液中,再按一定比例加入氨水或碳酸氢铵,此时溶液的温度会自行降低,并析出晶体,析出的晶体可用于造纸工业,也可用于照相用显影液的生产。已知该结晶水合物的相对分子质量为134,则其化学式为 ▲ 。生产中需要向溶液中加入适量的对苯二酚等物质,其作用是 ▲ 。
19. (12分)随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气为原料经由合成气(CO 、H2)制化学品是目前天然气转化利用的主导技术路线,主要工艺有以下几种:
(1)甲烷的部分氧化。CH4(g) + 1/2O2 (g) = CO (g) + 2H2(g) ,△H = -35.6 kJ/mol。该反应是 ▲ 反应(填“自发”、“非自发”或“一定条件下自发”)。有研究认为甲烷部分氧化的机理为:
①CH4(g) + 2O2 (g) = CO 2(g) + 2H2O(g) ,△H1 =-890.3 kJ/mol
②CH4(g) + CO2 (g) = 2CO (g) + 2H2(g) ,△H2 = 247.3 kJ/mol
③CH4(g) + H2O (g) = CO (g) + 3H2(g) ,△H3
 反应③的△H3= ▲ 。
反应③的△H3= ▲ 。
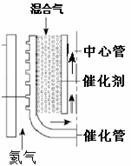
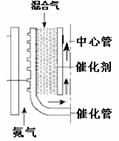
(2)甲烷水蒸汽催化重整。如图,反应时热氦气从下部流入提供能量。由甲烷和水蒸汽组成的混合气从催化管的上部流入,发生吸热反应,混合气从下端出来后再向上进入中心管,其目的是 ▲ 。根据下表数据计算甲烷
的转化率为 ▲ 。
|
气体 |
进口温度/℃ |
进口压强/MPa |
进口流量/g.s-1 |
出口流量/g.s-1 |
|
甲烷 |
464 |
4.26 |
12 |
5.4 |
(3)甲烷二氧化碳催化重整。高温下,该反应速率明显降低的原因可能是 ▲ 。
(4)甲烷的部分氧化与重整耦合。以天然气为燃料的发电尾气(主要含CO2、H2O、O2 和N2)与甲烷可直接用于制合成气,下列说法错误的是 ▲ 。(填字母序号)
A.直接利用烟气中的CO2,可以大规模地减少 CO2的排放量
B.烟气的出口温度较高,可以显著地节约能量
C.使用恰当的催化剂可以增大甲烷的转化率
D.由于反应体系中包含甲烷燃烧,可实现部分热量自供,降低成本
18. (12分)工业生产无铁硫酸铝,以硫酸浸取铝土矿得含铁(Fe2+和Fe3+)的硫酸铝溶液,加热到一定温度,搅拌,加入一定量高锰酸钾溶液和硫酸锰溶液,在溶液中生成活性二氧化锰,调节溶液的pH,反应一段时间,Fe (OH) 3和二氧化锰发生吸附共沉作用,最终得到无铁硫酸铝产品。


(1)KMnO4首先将Fe2+氧化为Fe3+,其本身被还原为MnO2,反应的离子方程式为 ▲ 。
(2)写出高锰酸钾溶液和硫酸锰溶液反应的化学方程式 ▲ 。实验证明,n(MnO2)/n(Fe)控制在4∶1时,除铁效果较好。若溶液中亚铁离子和铁离子浓度均为0.03 mol/L,为达到较好的除铁效果,每1 L溶液应加入高锰酸钾的物质的量为 ▲ 。
(3)调节pH的作用是 ▲ 。
(4)操作1的名称为 ▲ ,操作2的名称为 ▲ 。
(5)下列有关工艺的说法正确的是 ▲ 。(填字母序号)
A.可以向溶液中再加入铝土矿粉等调节pH
B.溶液的碱性越强,则除铁效果越好,但同时会影响硫酸铝的产率
C.活性二氧化锰生成量应适宜,不足时铁的去除率较低,过量时会增加成本
D.可以直接向溶液中加入二氧化锰粉末以除去Fe (OH) 3
17.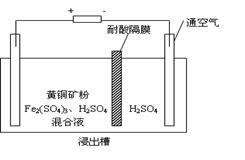 (8分)以石墨为电极,电解法处理黄铜矿(CuFeS2)精矿,可以制得硫酸铜溶液和单质硫。黄铜矿在阳极的浸出反应比较复杂,主要有:
(8分)以石墨为电极,电解法处理黄铜矿(CuFeS2)精矿,可以制得硫酸铜溶液和单质硫。黄铜矿在阳极的浸出反应比较复杂,主要有:
CuFeS2 + 4H+ = Cu2+ + Fe2+
+ 2H2S,
CuFeS2 + 4Fe3+ = Cu2+ + 5Fe2+
+ 2S,
2Fe3+ + H2S
= 2H+ + S↓ + 2Fe2+。右图为该工艺的示意图。
(1)电解过程实现了Fe3+的循环,则阳极方程式为 ▲
。
(2)电解过程中阴极析出的金属为 ▲ ,向阴极通空气的原因是 ▲
。
(3)与燃烧法炼铜相比,电解法的优点为 ▲ 。
16.(10分)二氧化氯(ClO2)作为一种高效强氧化剂,已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定。温度过高,二氧化氯的水溶液有可能爆炸。某研究小组设计如图所示实验制备ClO2。
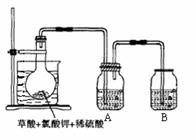 (1)如图,在烧瓶中先放入一定量的KClO3和草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热。反应后产物中有ClO2、CO2和一种酸式盐,该反应的化学方程式为: ▲ ,氧化产物与还原产物的物质的量之比为 ▲。
(1)如图,在烧瓶中先放入一定量的KClO3和草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热。反应后产物中有ClO2、CO2和一种酸式盐,该反应的化学方程式为: ▲ ,氧化产物与还原产物的物质的量之比为 ▲。
(2)控制水浴温度在60-80℃之间的目的是 ▲ ,图示装置中缺少的一种必须的玻璃仪器是 ▲ 。
(3)A装置用于吸收产生的二氧化氯,其中最好盛放
▲ 。(填序号)
①60 ℃的温水 ②冰水 ③饱和食盐水 
(4)将二氧化氯溶液加入到硫化氢溶液中,所得溶液中加入少量用稀硝酸酸化过的氯化钡溶液,有白色沉淀生成。请写出二氧化氯溶液和硫化氢溶液反应的离子方程式
▲ 。
15.(10分)我国化学家侯德榜改革国外的Na2CO3生产工艺,创造了侯氏制碱法,又叫联碱法,该法是将合成氨工厂生产的NH3及副产品CO2,通入到饱和食盐水中得到NaHCO3,分离出的NaHCO3加热制得Na2CO3。某研究性学习小组设计如下图所示的模拟装置,该装置可实现部分原料的循环使用。
 (1)分液漏斗甲中为盐酸,装置B中试剂为 ▲ ,分液漏斗乙中是易挥发的某试剂,该试剂为 ▲ 。
(1)分液漏斗甲中为盐酸,装置B中试剂为 ▲ ,分液漏斗乙中是易挥发的某试剂,该试剂为 ▲ 。
(2)实验操作过程中,应先打开 ▲ (填“k1”或“k2”),当观察到 ▲ 现象时,再打开另一个弹簧夹。
(3)装置E中试剂为饱和NaCl溶液,该装置能体现绿色化学思想的两个作用是 ▲ 、 ▲ 。
(4)老师认为在C、D之间还应增加一个装置,该装置作用为 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com