
7.在下列给定条件的溶液中,一定能大量共存的离子组是
A.无色溶液:Ca2+、H+、Cl-、HSO3-
B.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
C.FeCl3溶液:K+、Na+、SO42-、AlO2-
D.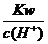 =0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
6. 下列装置所示的实验中,能达到实验目的的是




5.下列化学实验事实及其解释都正确的是
A.升高温度化学反应速率加快,是因为单位体积内活化分子百分数增加
B.将SO2通入BaCl2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸
C.鸡蛋清溶液中加入饱和CuSO4溶液析出沉淀,说明蛋白质发生了盐析
D.滴有酚酞的Na2CO3溶液中滴加BaCl2溶液后红色变浅,说明BaCl2溶液有酸性
4.下表所列各组物质中,物质之间通过一步反应不能实现如下图所示转化的是
|
选项 |
a |
b |
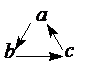 c c |
|
A |
Fe |
FeCl3 |
FeCl2 |
|
B |
Al(OH)3 |
NaAlO2 |
Al2O3 |
|
C |
HNO3 |
NO |
NO2 |
|
D |
CH2=CH2 |
CH3CH2Br |
CH3CH2OH |
3.设NA为阿伏加德罗常数的值,下列叙述中正确的是
A.标准状况下,11.2 L乙醇完全燃烧生成CO2分子数为NA
B.pH=13的氢氧化钠溶液中所含Na+数为0.1NA
C.14 g乙烯和丙烯的混合气体中所含原子总数为3NA
D.5.6 g铁与足量的氯气反应失去电子数为 0.2NA
2.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是
A.CO2的电子式: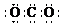
B.S2-的结构示意图:
C.乙烯的结构简式:C2H4
D.质量数为37的氯原子: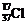
1.化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是
A.北京奥运会燃放的焰火是某些金属元素焰色反应所呈现出来的色彩
B.加热能杀死甲型H1N1流感病毒是因为病毒的蛋白质受热变性
C.太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置
 D.废旧电池应集中回收,并填埋处理
D.废旧电池应集中回收,并填埋处理
(二)精炼铜的时候粗铜作为 极材料,精铜作为 极材料,电解质溶液是 ,阳极发生的电极反应式为 、 。(粗铜杂质主要为Zn、Ag、Au等)
16.(10分)工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝。工艺流程如下图:
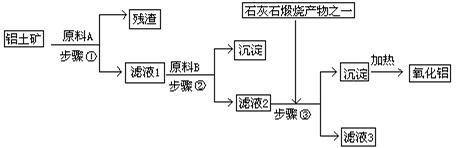
(1) 原料A的名称是_________,步骤①反应的离子方程式是_________________。
(2) 滤液1中要加入稍过量原料B,原料B的化学式是________________,步骤②反应的离子方程式是:__________________________________________。
(3) 步骤③的化学方程式是:_____________________________________________。
(4) 如果省去步骤①,即溶解铝土矿是从加入原料B开始,则会对氧化铝的提取有什么影响___________________________________________________________________。
17.(11分)将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
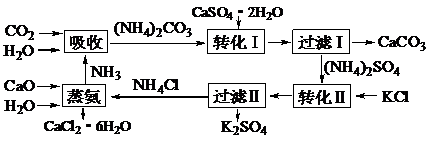
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要 等原料。
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式: _______ 。
(3)过滤I操作所得固体中,除CaCO3外还含有 (填化学式)等物质,该固体可用作生产水泥的原料。
(4)过滤I操作所得滤液是(NH4)2SO4溶液。检验滤液中含有CO32 -的方法是: 。
(5)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是
a.熔点较低(29 ℃熔化) b.能导电 c.能制冷 d.无毒
(6) 上述工艺流程中体现绿色化学理念的是:___________________________。
18.(10分)某烃类化合物A的相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
(1)A的结构简式为 ;
(2)A中的碳原子是否都处于同一平面? (填“是”或者“不是”);
(3)在下图中,D1 、D2互为同分异构体,E1 、E2互为同分异构体。
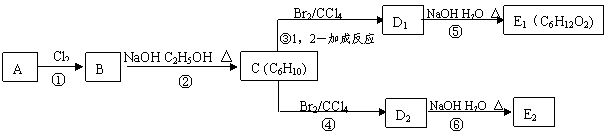
反应②的化学方程式为 ;C的化学名称为 ;E2的结构简式是 ;④、⑥的反应类型依次是 
 、 。
、 。
19. (12分)根据图示回答下列问题:
 (1)写出A、E、G的结构简式:A____________,E____________,G_____________;
(1)写出A、E、G的结构简式:A____________,E____________,G_____________;
(2)反应②的化学方程式(包括反应条件)是___________________________________,
反应④化学方程式(包括反应条件)是____________________________________;
(3)写出①、⑤的反应类型:①________________、⑤__________________。
20.(6分)一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的NaOH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500 mol。
(1)原NaOH溶液的质量分数为 。
(2)所得溶液中Cl-的物质的量为 mol。
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)= 。
21.(12分) (物质结构与性质)新型节能材料高温超导体的最先突破是在1987年从新的钇钡铜氧材料的研究开始的。在制备钇钡铜氧高温超导体的同时,偶然得到了副产品--紫色的硅酸铜钡。凑巧的是,后者正是发现于中汉代器物上的被称为“汉紫”的颜料,还发现于秦俑彩绘。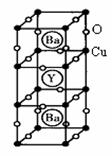 钇钡铜氧的晶胞结构如图。研究发现,此高温超导体中的铜元素有两种价态,+2价和+3价。
钇钡铜氧的晶胞结构如图。研究发现,此高温超导体中的铜元素有两种价态,+2价和+3价。
(1)给出铜在周期表中的位置(周期和族)
(2)写出基态Cu原子的核外电子排布:
(3)根据图示晶胞结构,推算晶体中Y,Cu,Ba和O原子个数比,确定其化学式为:
(4)①某+1价铜的配离子为[Cu(CN)4]3-,与其配体互为等电子体的一种微粒是 (写化学式)。
②许多+1价铜的化合物的溶液能吸收CO和烯烃(如C2H4、CH3-CH=CH2……),CH3-CH=CH2分子中C原子的杂化方式是 、 。
(5)在硫酸铜溶液中逐滴加入氨水至过量,观察到先出现蓝色沉淀,最终沉淀溶解得到深蓝色的溶液。写出蓝色沉淀溶解的离子方程式 。
14.下列操作会使H2O的电离平衡向电离方向移动,且pH<7的是
A.向水中加少量Na2CO3 B.向水中加少量HCl
C.向水中加少量FeCl3 D.将纯水加热到90℃
第II卷 非选择题(共72分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com