
17.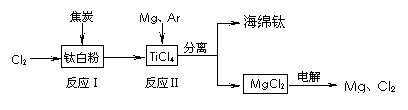 (10分)21世纪是钛的世纪。下面是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程:
(10分)21世纪是钛的世纪。下面是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程:
已知:
① Mg(s)+Cl2 (g)=MgCl2 (s) △H=-641 kJ·mol-1
② Cl2(g)+1/2Ti (s)=1/2TiCl4 (l) △H=-385 kJ·mol-1
(1)钛白粉是利用TiO2+发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的。TiO2+发生水解的离子方程式为 ▲ 。
 (2)反应Ⅰ在800-900℃下进行,还生成一种可燃性无色气体,该反应的化学方程式为 ▲ ;反应Ⅱ的热化学方程式为 ▲ 。
(2)反应Ⅰ在800-900℃下进行,还生成一种可燃性无色气体,该反应的化学方程式为 ▲ ;反应Ⅱ的热化学方程式为 ▲ 。
(3)该工艺流程中,可以循环使用的物质有 ▲ 。
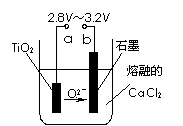
(4)在800℃-1000℃时电解TiO2也可制得海绵钛,装置如右图所示。图中b是电源的 ▲ 极,阴极的电极反应式为 ▲ 。
16.
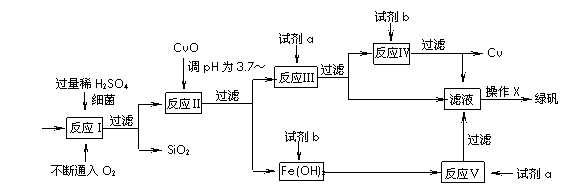 (8分)以黄铜矿(主要成份为CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下:
(8分)以黄铜矿(主要成份为CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下:
|
已知:① 4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
② 部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下表
|
沉淀物 |
Cu(OH)2 |
Fe(OH)3 |
Fe(OH)2 |
|
开始沉淀pH |
4.7 |
2.7 |
7.6 |
|
完全沉淀pH |
6.7 |
3.7 |
9.6 |
(1)试剂a是 ▲ ,试剂b是 ▲ 。
(2)操作X应为蒸发浓缩、 ▲ 、 ▲ 。
(3)反应Ⅱ中加CuO调pH为3.7-4的目的是 ▲ ;
(4)反应Ⅴ的离子方程式为 ▲ 。
15.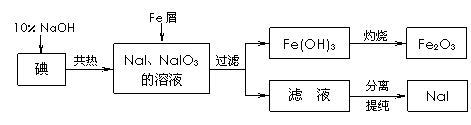 (10分)碘化钠是实验室中常用的分析试剂,也常用于医疗和照相业。工业上用铁屑还原法制备NaI,其主要流程如下图,请回答下列问题:
(10分)碘化钠是实验室中常用的分析试剂,也常用于医疗和照相业。工业上用铁屑还原法制备NaI,其主要流程如下图,请回答下列问题:
(1)判断碘是否已完全反应的实验方法是 ▲ ;
(2)将滤液在低温下分离出NaI样品的过程中,要防止NaI被氧化,最好采取的措施是
▲ ;
(3)测定产品中NaI含量的方法是:a.称取3.000 g样品、溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.1000 mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为19.00 mL。
① 上述测定过程所需仪器中,需要检查是否漏液的仪器有 ▲ 。
② 上述样品中NaI的质量分数为 ▲ 。
③ 若用上述方法测定产品中NaI的质量分数偏低(测定过程中产生的误差忽略不计),其可能原因有 ▲ 。
14.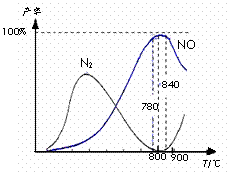 氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如右图。
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如右图。
4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
△H=-905 kJ·mol-1 ①
4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
2N2(g)+6H2O(g)
△H=-1268 kJ·mol-1 ②
下列说法中正确的是
A.工业上氨催化氧化生成 NO时,温度应控制在
780-840℃之间
B.工业上采用物料比n(O2)/n(NH3)在1.7-2.0,主要是为了提高反应速率
C.加压可提高NH3生成NO的转化率
D.N2氧化为NO的热化学方程式为:N2(g)+O2(g) 2NO(g) △H=+181.5 kJ·mol-1
2NO(g) △H=+181.5 kJ·mol-1
非选择题
13.下列溶液中微粒的物质的量浓度关系正确的是
A.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
B.pH=2的HA溶液与pH=12的MOH溶液以任意比混合:
c(H+)+c(M+)=c(OH-)+c(A-)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.某二元弱酸的酸式盐NaHA溶液中:
 c(H+)+2c(A2-)=c(OH-)+c(H2A)
c(H+)+2c(A2-)=c(OH-)+c(H2A)
12.某氢氧燃料电池的电解质溶液为KOH溶液,下列有关该电池的叙述正确的是
A.正极反应式为:O2+2H2O+4e-=4OH-
B.电池工作时,OH-向正极移动
C.工作一段时间后,电解质溶液的pH变大
D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol e-转移
11.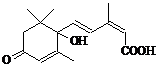 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开。S-诱抗素的分子结构如右图,下列关于该物质的说法正确的是
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开。S-诱抗素的分子结构如右图,下列关于该物质的说法正确的是
A.其分子式为C15H22O4
B.1 mol该物质与NaOH溶液反应,最多消耗2 mol NaOH
C.既能发生加聚反应,又能发生缩聚反应
D.既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色
10.下列离子方程式中正确的是
A.实验室用烧碱溶液除去尾气中的Cl2:Cl2+OH-=Cl-+HClO
B.向AlCl3溶液中滴加过量氨水制备Al(OH)3:
Al3++3NH3·H2O=Al(OH)3↓+3NH4+
C.用惰性电极电解饱和MgCl2溶液:2Cl-+2H2O C12↑+H2↑+2OH-
C12↑+H2↑+2OH-
D.用FeCl3溶液腐蚀铜制印刷电路板:Fe3++Cu=Fe2++Cu2+
9.下列实验能达到目的的是
 A.将金属钠在研钵中研成粉末,以便钠与水反应的实验更安全
A.将金属钠在研钵中研成粉末,以便钠与水反应的实验更安全
B.用NaOH溶液浸泡铝箔,以除去其表面的氧化膜
C.向新制的AgCl悬浊液中滴加KI溶液,有黄色沉淀生成,证明同温度下:
Ksp(AgI)<Ksp(AgCl)
D.将10滴溴乙烷加到1 mL 10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验溴乙烷是否发生了水解
8.甲、乙、丙、丁4种物质分别含2种或3种元素,它们的分子中各含l8个电子。甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是
A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应
B.乙和甲中同种元素的质量分数相等,则乙中一定含有-l价的元素
C.丙与氧气的摩尔质量相同,则丙一定含有极性键和非极性键
D.丁中含有第2周期ⅣA族的元素,则丁一定是甲烷的同系物
不定项选择题:本题包括6小题,每小题4分,共计24分。每小题有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com