
2.大胆、科学的假设与猜想是科学探究的先导和价值所在。在下列假设(猜想)引导下的探究肯定是没有意义的是 
A.探究SO2和Na2O2反应可能有Na2SO4生成 
B.探究Na与水的反应可能有O2生成 
C.探究浓硫酸与铜在一定条件下反应产生的黑色物质中可能有CuS 
D.探究向滴有酚酞试液的Na0H溶液中通以 Cl2,酚酞红色褪去的现象是溶液的酸碱性改变所致,还是HClO的漂白性所致
1.化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。下列实验中所选用的仪器合理的是
①用50mL量筒取4.2mL稀硫酸; ②用分液漏斗分离苯和四氯化碳的混合物;③用托盘天平称量11.7g氯化钠晶体;④用碱式滴定管取23.10mL溴水; ⑤用瓷坩埚灼烧各种钠的化合物;⑥用250mL容量瓶配制250mL 0.2mol/L的NaOH溶液。
A.①②④ B.②③④⑥ C.③⑥ D.③⑤⑥
6.(2)D(2分)
(3)72×103(2分)
(4)反应SO2+I2+2H2O=H2SO4+2HI(1分)
n(SO2)=n(I2)=20×10-3 L×0.025 mol/L=0.0005 mol(1分)
V(SO2)=0.0005 mol×22.4 L/mol=0.0112 L(1分)
V(SO2)%=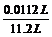 ×100%=0.1%>0.05%,故不能直接排放(1分)
×100%=0.1%>0.05%,故不能直接排放(1分)
(其他合理过程酌情给分)
21A.(12分)
(1)1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3(2分)
(2)4(2分)
(3)BCDE(2分,写对1个得0分,写对2-3个得1分,有错得0分)
(4)三角锥形(2分) sp2(2分)
(5)NH3分子间能形成氢键,而AsH3分子间不能形成氢键(2分,没有强调分子间氢键的得1分,回答分子内氢键的得0分)
21B.(12分)
(1)驱赶其中溶解的CO2,防止滴定时消耗一定量的NaOH溶液,导致测定结果偏高(2分)
(2)偏高(2分)
(3)C(2分)
(4)② 边加边振荡锥形瓶(2分)
④ 当最后一滴NaOH标准溶液滴入,溶液的颜色由无色突然变为粉红色,且在半分钟内不褪色(2分)
(5)4.795 g/100 mL(2分)

20.(10分)
(1)B(2分)
19.(12分)
(1)氨基、羧基(苯基写不写均可,但必须写出“氨基”和“羧基”)(每个1分,共2分)
(2)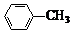 +Cl2光
+Cl2光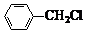 +HCl(2分)
+HCl(2分)
(3)取代(1分) 缩聚 (1分)
(4)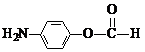 (2分,结构简式写错得0分)
(2分,结构简式写错得0分)
(5)(每步1分,共4分)
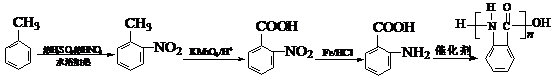
(结构简式、反应条件错1个扣1分,扣完为止)
18.(10分)
(1)杀菌消毒、吸附悬浮物(或其他合理答案)(各1分,共2分)
(2)探究温度对FeO42-浓度的影响(或其他合理答案)(1分) >(1分)
(3)C(2分)
(4)① CrO2-+FeO42-+2H2O=Fe(OH)3↓+CrO42-+OH-(2分)
② 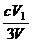 (2分)
(2分)
17.(10分)
|
(2)TiO2+2Cl2+2C
TiCl4+2CO(2分)
2Mg(s)+TiCl4(l)=2MgCl2(s)+Ti(s) △H=-512 kJ·mol-1(2分,状态不写得0分)
(3)Mg、Cl2(共2分,各1分)
(4)正(1分) TiO2+4e-=Ti+2O2-(2分)
16.(8分)
(1)Fe(或铁) 稀硫酸(或稀H2SO4) (每空1分,共2分)
(2)冷却结晶 过滤(洗涤干燥)(每空1分,共2分)
(3)使Fe3+形成Fe(OH)3沉淀 防止生成Cu(OH)2沉淀(各1分,共2分,合理答案也给分)
(4)Fe+2Fe3+=3Fe2+(2分)(全卷化学方程式、离子方程式统一评分标准:化学式写错得0分;配平、反应条件、箭号错误共扣1分)
15.(每空2分,共10分)
(1)取少量反应后的混合液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已完全反应;反之,则未完全反应
(2)隔绝空气分离(或其他合理答案)
(3)①250 mL容量瓶、酸式滴定管 ② 95.00% ③样品在空气中被氧化(或样品在空气中吸水)
21.
A.(12分)
(1)
(2)
(3)
(4)
(5)
B.(12分)
(1)
(2)
(3)
(4)②
④
(5)
南京市2010届高三学情分析样题
|
选择题
非选择题
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com