
20.(15分)某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
①称量a g样品,置于烧杯中;
②加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,加热使反应完全;
④趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……
请根据上面叙述,回答:
(1)下图所示仪器中,本实验步骤①②③中必须用到的仪器是E和 (填字母)。

A B C D E F G
(2)写出步骤③中发生反应的离子方程式 。
(3)洗涤是洗去附着在沉淀上的 (写离子符号),洗涤沉淀的操作是 。
(4)第⑥步的操作中,将沉淀物加热,冷却至室温,称量其质量为m1g;再次加热并冷却室温称量其质量为m2g,且m1-m2=0.3,接下来的操作应当是 。
(5)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为
。(列出算式,不需化简)
(6)该兴趣小组中甲学生认为:实验步骤③中不加入氯水,其余步骤不变,仍可达到实验目的。你认为甲学生的观点是否正确? (填正确或错误);请说明理由:
。
19.(12分)已知X为中学化学中的一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的最高价氧化物是耐火材料,它的晶体硬度很大,常做手表的轴承;H为气体单质,D为无色气体,在空气中会出现红棕色。各物质的转化关系如下图(部分反应产物已略去)。

请回答下列问题:
(1)X的化学式为 。
(2)N在氧气中燃烧的实验现象是 。
(3)在反应①②③④中属于置换反应的是 (填序号)。
(4)反应②的离子方程式为 。
(5)X溶液与F反应的总化学方程式为 。
(6)若向100 mL 盐X的溶液中加入10 g金属单质M的粉末,充分搅拌后,过滤,烘干得10.16g固体C。则滤液A中溶质的物质的量浓度为 。
18. (10分)373w.w.w.k.s.5.u.
c.o.m343近年来,我国酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
(10分)373w.w.w.k.s.5.u.
c.o.m343近年来,我国酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
⑴有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下: ( I )将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。(III)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用。
① 写出步骤(I)反应的化学方程式:
② 写出步骤(III)反应的离子方程式:
⑵还有学者提出利用 Fe 2十、Fe3十等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率。
 w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
① 该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是(填序号) 。

A.碘的淀粉溶液 B.酸性高锰酸钾溶液 C.氢氧化钠溶液 D.氯化钡溶液
② 若上述实验是在标准状况下进行的,X是已知体积和物质的量浓度的溶液,欲测定转化器中SO2氧化成SO42一的转化率,已知气体流速,还需测定的数据是
(3)新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应,在反应回收SO2后的混合物中通入适量的氨气得到一种产品。该技术的优点是 。
(4)为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO=2CO2+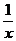 Sx 、
Sx 、
CO+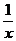 Sx=COS、2COS+SO2=2CO2+
Sx=COS、2COS+SO2=2CO2+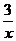 Sx 。其中COS中“C”化合价为
。
Sx 。其中COS中“C”化合价为
。
17.(9分)W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素,Y元素的单质在常温下为淡黄色固体。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐,该反应的离子方程式为________________ ____。
(2)X的硝酸盐水溶液显______性,用离子方程式解释原因____ _______
_____________。
(3)比较Y、Z气态氢化物的稳定性_____>_______(用分子式表示)
(4)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出QkJ的热量。写出该反应的热化学方程式:_______________________。
16. 将4.6 g Na和2.7 g Al同时加入到足量的水中充分反应,将反应后的溶液稀释、定容为500mL。下列说法正确的是
将4.6 g Na和2.7 g Al同时加入到足量的水中充分反应,将反应后的溶液稀释、定容为500mL。下列说法正确的是
 A.反应中放出的气体在标准状况下的体积为2.24 L
A.反应中放出的气体在标准状况下的体积为2.24 L
 B.参加反应的水的质量与加入Al的质量相等
B.参加反应的水的质量与加入Al的质量相等
 C.所得溶液中Na+和Al3+的物质的量之比为2∶1
C.所得溶液中Na+和Al3+的物质的量之比为2∶1
 D.所得溶液中阳离子和阴离子的物质的量之比为1∶1
D.所得溶液中阳离子和阴离子的物质的量之比为1∶1

第II卷(非选择题 52分)
15. 某研究性学习小组在老师指导下做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色。判断下列说法中正确的是( )
某研究性学习小组在老师指导下做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色。判断下列说法中正确的是( )
 A.该条件下生成的水分子化学性质比较活泼
A.该条件下生成的水分子化学性质比较活泼

 B.该条件下H2被冷却为液态氢,液氢的水溶液具有
B.该条件下H2被冷却为液态氢,液氢的水溶液具有
 还原性
还原性
 C.该条件下H2燃烧生成了具有还原性的物质
C.该条件下H2燃烧生成了具有还原性的物质
 D.该条件下H2燃烧的产物中可能含有一定量的H2O2
D.该条件下H2燃烧的产物中可能含有一定量的H2O2
14. 混合下列各组物质使之充分反应并加热蒸干,产物灼烧至质量不变,最终残留固体不是纯净物的是( )
混合下列各组物质使之充分反应并加热蒸干,产物灼烧至质量不变,最终残留固体不是纯净物的是( )
 A.在KI溶液中通入过量氯气
A.在KI溶液中通入过量氯气
 B.等物质的量浓度、等体积的(NH4)2SO4溶液与BaCl2溶液混合
B.等物质的量浓度、等体积的(NH4)2SO4溶液与BaCl2溶液混合
 C.物质的量之比为2:1的NaHCO3与Na2O2固体溶于水中
C.物质的量之比为2:1的NaHCO3与Na2O2固体溶于水中
 D.向Na2SiO3溶液中通入足量的CO2
D.向Na2SiO3溶液中通入足量的CO2
13. 下列说法或表示方法中正确的是( )
下列说法或表示方法中正确的是( )
A.  等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
 B.由C(金刚石)→C(石墨);ΔH=+119KJ/mol
可知,石墨比金刚石稳定
B.由C(金刚石)→C(石墨);ΔH=+119KJ/mol
可知,石墨比金刚石稳定
 C.在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);ΔH=-285.8KJ/mol
C.在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);ΔH=-285.8KJ/mol
 D.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);ΔH=-53.7KJ/mol ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ/mol
D.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);ΔH=-53.7KJ/mol ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ/mol
12、 下列各组溶液中所含溶质的物质的量相等,将其充分混合后不会产生沉淀的是( )
下列各组溶液中所含溶质的物质的量相等,将其充分混合后不会产生沉淀的是( )
 A.CaCl2、NaHCO3、KOH B.MgCl2、Ba(OH)2、HCl
A.CaCl2、NaHCO3、KOH B.MgCl2、Ba(OH)2、HCl
 C.FeCl3、H2S、HCl D.NaAlO2、K2CO3、NH3·H2O
C.FeCl3、H2S、HCl D.NaAlO2、K2CO3、NH3·H2O
11. 如图,B为常见金属或非金属单质,有下列转化关系:
如图,B为常见金属或非金属单质,有下列转化关系:

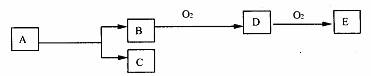





 若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是( )
若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是( )
 A.AlCl3 B.H2O2 C.KCl D.NaCl
A.AlCl3 B.H2O2 C.KCl D.NaCl
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com