
21.(16分)已知X、Y、Z、W是短周期元素中的四种非金属元素,它们的原子序数依次增大。X元素的原子形成的离子就是一个质子;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体;Y原子的最外层电子数是内层电子数的2倍。
(1)请写出元素符号: W
(2)在一定条件下,由X单质与Z单质反应生成1molE放出的热量为46.2kJ,写出该反应的热化学方程式: ;E在催化剂存在的条件下,可用于还原汽车尾气中的 ,以减少对大气的污染。
(3)Z的常见氢化物空间构型是 ,该物质形成的晶体属于 (填晶体类型),它的另一种氢化物Z2H4可作火箭燃料,其电子式是 。
(4)工业上可用E的浓溶液来检验输送氯气的管道是否漏气,若漏气时可观察到大量白烟,同时有单质Z生成,写出相应的化学方程式: 。该反应中被氧化的E与参与反应的E的质量之比为 。
20.(8分)具有水果香味的中性物质A可以发生下列变化:
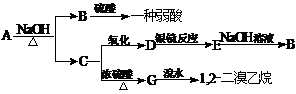
(1) 推断下述物质的结构简式:
A: D:
(2) 写出下列变化的化学方程式:
A+NaOH→B+C:
C→G:
19.(12分)合金A由4种单质组成,经过一系列反应分别进入了沉淀或气体中.
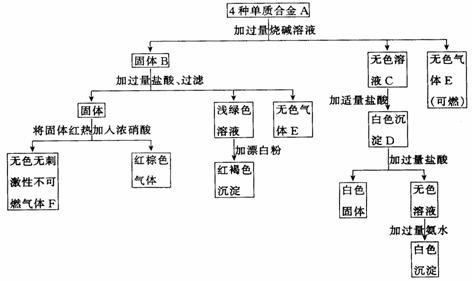
试回答:
(1)合金A由哪4种元素的单质组成? 、 、 、 .
(2)写出固体B、溶液C有关组成的化学式: B 、C .
(3)写出合金A中的有关组成与过量烧碱溶液反应生成无色气体E的化学反应方程式: .
(4)向无色溶液C加适量盐酸生成白色沉淀D。写出有关反应的离子方程式:
.
18.(8分)硅单质及其化合物应用范围很广。请回答下列问题:
 (1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
①写出由纯SiHCl3制备高纯硅的化学反应方程式 。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式 ;H2还原SiHCl3过程中若混O2,可能引起的后果是 。
(2)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释 。
17.(6分)a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:


d是由极性键构成的四原子极性分子;c与f可作用形成共价型g分子。
试写出:
(1)a微粒的结构示意图
;
(2)比较b、e的离子半径b e,b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为(用化学式表示) >
;
(3)c微粒是 ,f微粒是 (用化学式表示)。
16.(8分)利用天然气合成氨的工艺流程示意图如下:
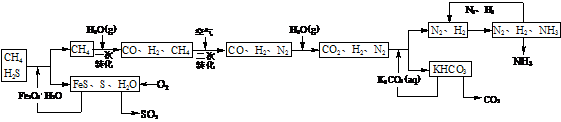

依据上述流程,完成下列填空:
⑴图中CH4的一次转化过程中的化学方程式是 。
⑵脱硫过程中,若有n mol Fe2O3·H2O转化,则反应掉H2S物质的量为 mol(用含n的代数式表示)。
⑶整个流程有三个循环:一是K2CO3(aq)循环,二是N2和H2循环,第三个循环中被循环物质是
。 
⑷改用过量NaOH溶液吸收天然气中的硫化氢,以石墨作电极电解吸收后所得溶液可回收得到硫,同时得到副产物H2。其电解总反应方程式(忽略氧气的氧化还原)为
。
15.(14分)聚合氯化铝是新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝[Al2(OH)nCl6-n]。
本实验采用铝盐溶液水解絮凝法制备碱式氯化铝。其制备原料为高岭土,化学组成为:Al2O3(25%-34%)、SiO2(40%-50%)、Fe2O3(0.5%-3.0%)以及少量杂质和水分。已知氧化铝有多种不同的结构,化学性质也有差异,且一定条件下可相互转化;高岭土中的氧化铝难溶于酸。制备碱式氯化铝的实验流程如下:


根据流程图回答下列问题:
⑴“煅烧”的目的是 。
⑵配制质量分数15%的盐酸需要200 mL 30%的浓盐酸(密度约为1.15 g·cm-3)和 g蒸馏水,配制用到的仪器有烧杯、玻璃棒、 。
⑶“溶解”过程中发生反应的离子方程式为 。
⑷加适量铝粉的主要作用是 。
⑸“调节溶液pH在4.2-4.5”的过程中,除添加必要的试剂,还需借助的实验用品是 ;“蒸发浓缩”需保持温度在90-100℃,控制温度的实验方法是 。

14.有8.3g镁和铝的混合粉末溶于4mol/L的盐酸750mL中。若加入2mol /L的氢氧化钠溶液,要使产生的沉淀的质量最大,则需加入的氢氧化钠溶液的体积为
A.100mL
B.500mL C.1000mL D.1500mL

第II部分(非选择题)
13.下列化学反应的离子方程式正确的是
A.向Ba(OH)2溶液中滴加NH4HSO4。溶液至刚好沉淀完全:
Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3·H2O+H2O
B.氧化铁溶于过量氢碘酸:Fe2O3+6H+ = 2Fe3++3H2O
C.将少量SO2气体通入足量的NaClO溶液中:SO2+2ClO-+H2O=SO32-+2HClO
D.稀硝酸中加入过量的铁屑:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
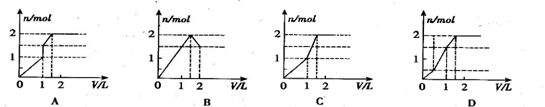
12.向含 l mol HCl和l mol MgSO4的混合溶液中加入1 mol/L Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是






湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com