
35.(18分)如图所示,处于匀强磁场中的两根足够长、电阻不计的平行金属导轨相距lm,导轨平面与水平面成θ=37°角,下端连接阻值为R的电阻.匀强磁场方向与导轨平面垂直.质量为0.2kg、电阻不计的金属棒放在两导轨上,棒与导轨垂直并保持良好接触,它们之间的动摩擦因数为0.25.
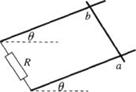 (1)求金属棒沿导轨由静止开始下滑时的加速度大小;
(1)求金属棒沿导轨由静止开始下滑时的加速度大小;
(2)当金属棒下滑速度达到稳定时,电阻R消耗的功率
为8W,求该速度的大小;
(3)在上问中,若R=2Ω,金属棒中的电流方向由a到b,
求磁感应强度的大小与方向.
(g=10m/s2,sin37°=0.6, cos37°=0.8)
高三理综联考生物答案
单选题(24分)1.C 2.C 3.A 4.C 5.D 6.B
双选题(12分)17.AC 18.AC
非选择题(64分)
34.(15分)下表列出了某种型号轿车的部分数据,试根据表中数据回答下列问题:
|
长/mm×宽/mm×高/mm |
4871×1835×1460 |
|
净重/kg |
1500 |
|
传动系统 |
前轮驱动与挡变速 |
|
发动机型式 |
直列4缸 |
|
发动机排量(L) |
2.2 |
|
最高时速(km/h) |
252 |
|
0-108km/h的加速时间(s) |
10 |
|
额定功率(Kw) |
140 |
 (1)右图为轿车中用于改变车速的排挡.手推变速杆到达不同挡位,可获得不同的运行速度,从“1-5”逐挡速度增大,R是倒车挡.试问轿车要以最大动力上坡,变速杆应推至哪一挡?并说明理由.
(1)右图为轿车中用于改变车速的排挡.手推变速杆到达不同挡位,可获得不同的运行速度,从“1-5”逐挡速度增大,R是倒车挡.试问轿车要以最大动力上坡,变速杆应推至哪一挡?并说明理由.
(2)该车以额定功率和最高速度运行时,轿车的牵引力为多大?
(3)如果把0-108km/h的加速过程看做匀加速直线运动,则此过程中汽车的加速度为多大?
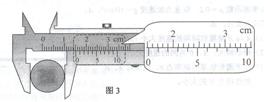
33.(每空3分,共21分)(1) 用游标为10分度(测量值可准确到O.1mm)的卡尺测量小球的直径。某次测量的示数如图3所示,读出小球直径d的值为 cm。
(2)在“验证机械能守恒定律”实验中,打点计时器接在电压为U、频率为f的交流电源上,在实验中打下一条清晰的纸带,如图8所示,从A点开始,每两个点取一个计数点,得到连续5个计数点A、B、C、D、E。测出起始点O到A点的距离为s0, O、C两点间的距离为s1,O、E两点间的距离为s2,重锤的质量为m,已知当地的重力加速度为g,则

①从打下起始点O到打下C点的过程中,重锤重力势能的减少量ΔEp= ,重锤动能的增加量ΔEk=
②重锤下落的加速度a= 。
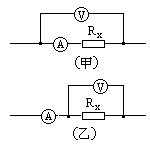 (3)一个未知电阻Rx,无法估计它的阻值大约是多少,今将伏安法测电阻的两种连接电路各试用一次,如图中(甲)和(乙),得到两组表的读数,图(甲)读数为3V,3mA,图(乙)读数为3V,4mA.请比较两组读数,你认为取_______种电路测量较好,此电阻Rx的实验测量值是______kΩ,它比真实值______些(填大或小).
(3)一个未知电阻Rx,无法估计它的阻值大约是多少,今将伏安法测电阻的两种连接电路各试用一次,如图中(甲)和(乙),得到两组表的读数,图(甲)读数为3V,3mA,图(乙)读数为3V,4mA.请比较两组读数,你认为取_______种电路测量较好,此电阻Rx的实验测量值是______kΩ,它比真实值______些(填大或小).
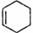
32.(14分)已知:CH2=CH-CH=CH2+CH2=CH2
 ,物质A在体内脱氢酶的作用下会氧化为有害物质GHB。下图是关于物质A的一种制备方法及由A引发的一系列化学反应。
,物质A在体内脱氢酶的作用下会氧化为有害物质GHB。下图是关于物质A的一种制备方法及由A引发的一系列化学反应。
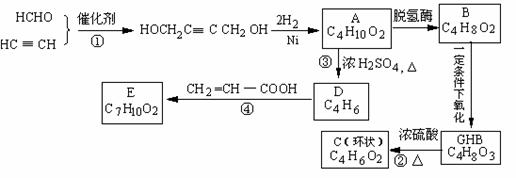
请回答下列问题:
⑴写出反应类型 反应① 反应③ 。
⑵写出化合物B的结构简式
。
⑶写出反应②的化学方程式 。
⑷写出反应④的化学方程式 。
⑸反应④中除生成外,还可能存在一种副产物(含 结构),它的结构简式为
。
结构),它的结构简式为
。
31.(18分)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
⑴冶炼铜的反应为: 8CuFeS2+21O2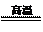 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
⑵上述冶炼过程产生大量SO2。下列处理方案中合理的是 (填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO4 d.用浓硫酸吸收
⑶过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:
S2O82- + 2I - = 2SO42- + I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程。
、 (不必配平)
⑷利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.除去Al3+的离子方程式是 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为 。
证明炉渣中含有FeO的实验现象为 。
30.(14分)在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
⑴写出该反应的平衡常数表达式:K= 。
已知: >
> ,则该反应是 热反应。
,则该反应是 热反应。
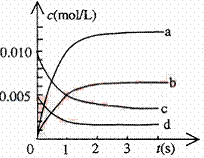 ⑵右图中表示NO2的变化的曲线是
。
⑵右图中表示NO2的变化的曲线是
。
用O2表示从0~2s内该反应的平均速率v= 。
⑶能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆 (NO)=2v正 (O2) d.容器内密度保持不变
⑷ 为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
29.(18分)W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为 。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为 。
(3)X的硝酸盐水溶 液显 性,用离子方程式解释原因 。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为:
。
(5)比较Y、Z气态氢化物的稳定性: > (用分子式表示)。
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:
> > > 。
(7)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出QkJ的热量。写出该反应的热化学方程式:
28.(16分)
某生物研究小组的同学,通过网络收集到有关三聚氰胺的资料如下:
科学家通过动物毒理学试验表明:以三聚氰胺给小鼠灌胃的方式进行急性毒性试验,灌胃后死亡的小鼠输尿管中均有大量晶体蓄积,部分小鼠肾脏被晶体覆盖。晶体成分是三聚氰胺和尿酸。肾中晶体可以用红外微光谱仪进行分析。若用连续加有三聚氰胺的饲料喂养动物,进行亚慢性毒性试验,试验动物肾小管管腔中出现晶体。通过为期13周的大白鼠结石试验,最低无明显作用剂量为63毫克/公斤/每日。
该小组同学为了验证三聚氰胺污染的食品可导致动物肾结石的发生,结合上述实验资料设计了如下实验方案,据此回答下列问题。
(1)材料用具:鼠龄一致、发育正常、体重、健康状况相近、各项指标符合要求的雌雄小鼠各40只,普通饲料,三聚氰胺(用量:63毫克/公斤/每日),红外微光谱仪。
(2)实验原理: 。
(3)观察指标:___________________________________________________________。
(4)请帮助该研究小组完成以下实验方案的设计:
① ;
② ;
③ ;
④3周后, 。
(5)该生物兴趣小组严格按照上述实验方案操作,结果两组都未产生结石。
①可能原因是: 。
②相应改进措施: 。
27.(21分)1918年,发生了世界范围的大流感,当年死亡人数约4000万。现在已从1918年大流感受害者的组织样本中提取了该流感病毒RNA,并经实验分析确定其由8个基因组成,碱基总数为a,其中G的数量为b。据此推测:
(1)该病毒的基因控制合成的蛋白质最可能有 种。
(2)根据中心法则分析,该病毒遗传信息的传递过程与人体不同的步骤可能有
。
(3)抗体是由 分泌的,参与的细胞器有 20世纪30年代,科学家们发现1918年大流感幸存者体内存在完全可以阻断猪流感病毒毒力的抗体,而1918年后出生的人体内却没有这种抗体。这表明
。
(4)若我们接种了用该种流感病毒研制的疫苗,是否就可以预防现今的流行性感冒?为什么?
26. (27分)下图甲表示某植物叶肉细胞内的部分结构及相关的代谢过程。乙图表示某植物在光照充足的条件下,温度对光合作用和呼吸作用速率的影响。丙图表示在光照条件下改变CO2的供应,物质A和物质B的浓度变化情况。请据图分析回答:
(27分)下图甲表示某植物叶肉细胞内的部分结构及相关的代谢过程。乙图表示某植物在光照充足的条件下,温度对光合作用和呼吸作用速率的影响。丙图表示在光照条件下改变CO2的供应,物质A和物质B的浓度变化情况。请据图分析回答:
(1)如果甲图中的叶肉细胞处于2℃的环境中,气体转移基本停止的原因是_________________________________。
(2)乙图中M点表示的生物学意义是 。在M点时,叶绿体内ATP移动的方向是____________________。在M点时,可以发生甲图中的哪些过程?____________(用图中字母表示)。
(3)乙图中在40℃-60 ℃范围内,随着温度上升,呼吸作用和光合作用的变化速率不同,其主要原因是 ,
(4)丙图显示,在光照下物质A和物质B的浓度很快达到饱和并保持稳定。此时突然中断CO2的供应,A、B物质的浓度将发生变化。其中,固定二氧化碳的化合物是______ _(用图中字母表示),二氧化碳转化的第一个产物是 (用图中字母表示)。
(5)卡尔文给小球藻悬浮液通入14CO2,光照一定时间(从1秒到数分钟)后杀死小球藻,同时提取产物并分析。实验发现,仅仅30秒的时间,二氧化碳已经转化为许多种类的化合物。想要探究CO2转化成的第一个产物是什么,可能的实验思路是 ____________________________________________________________________。
(6)某兴趣小组做“绿叶中色素的提取与分离”实验。色素层析结果在滤纸条上色素带很淡,造成的原因可能有 。
(致少写三点)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com