
3.下列有关人类基因组计划的叙述错误的是
A、美国、英国、德国、日本、法国和中国参加了这项工作
B、中国承担了1%的测序任务
C、人类基因组计划的实施,对于人类疾病的诊治和预防具有重要意义
D、测定的是23条染色体上的DNA的碱基对排列顺序
2.右图所示的红绿色盲患者家系中,女性患者Ⅲ-9的性染色体只有一条X染色体,其他成员性染色体组成正常。Ⅲ-9的红绿色盲致病基因来自于
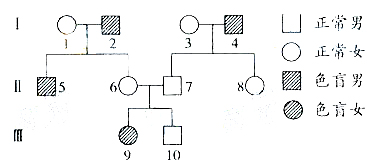 A.Ⅰ-1
A.Ⅰ-1
B.Ⅰ-2
C.Ⅰ-3
D.Ⅰ-4


1、 豌豆中,籽粒黄色(Y)和圆形(R)分别对绿色和皱粒为显性;现有甲(黄色圆粒)与乙(黄色皱粒)两株豌豆杂交,后代有4种表现型。理论上,甲自交和乙测交所产生的后代表现型之比分别为
A.9:3:3:1和I:1:1:1 B.3:3:1:1和1:1
C.9:3:3:1和1: 1
D.3:1和1:1
36. (18分)如图所示,光滑水平面AB与竖直面的半圆形导轨在B点衔接,导轨半径R,一个质量为m的静止物块在A处压缩弹簧,把物块释放,在弹力的作用下获得一个向右的速度,当它经过B点进入导轨瞬间对导轨的压力为其重力的7倍,之后向上运动恰能完成半圆周运动到达C点,求:
(18分)如图所示,光滑水平面AB与竖直面的半圆形导轨在B点衔接,导轨半径R,一个质量为m的静止物块在A处压缩弹簧,把物块释放,在弹力的作用下获得一个向右的速度,当它经过B点进入导轨瞬间对导轨的压力为其重力的7倍,之后向上运动恰能完成半圆周运动到达C点,求:
(1)弹簧对物块的弹力做的功;
(2)物块从B至C克服阻力所做的功;
(3)物块离开C点后落回水平面时动能的大小.


35. (18分)质量为M的木块放在水平台面上,台面比水平地面高出h=0.20m,木块离台的右端L=1.7m.质量为m=0.10M的子弹以v0=180m/s的速度水平射向木块,并以v=90m/s的速度水平射出,木块落到水平地面时的落地点到台面右端的水平距离为s=1.6m,求
(18分)质量为M的木块放在水平台面上,台面比水平地面高出h=0.20m,木块离台的右端L=1.7m.质量为m=0.10M的子弹以v0=180m/s的速度水平射向木块,并以v=90m/s的速度水平射出,木块落到水平地面时的落地点到台面右端的水平距离为s=1.6m,求
(1)木块碰撞后开始运动的速度v1
(2)木块离开台面时的速度为v2
(3)木块与台面间的动摩擦因数为μ.
34. Ⅰ.(10分)某同学在做平抛运动实验时得以了如图所示的物体运动轨迹,a、b、c三点的位置在运动轨迹上已标出。则:
Ⅰ.(10分)某同学在做平抛运动实验时得以了如图所示的物体运动轨迹,a、b、c三点的位置在运动轨迹上已标出。则:
(1)小球平抛的初速度为 m/s。(g取10m/s2)
(2)小球开始做平抛运动的位置是否在O点: (填“是”或“否”)
(3)小球运动到b点的速度为 m/s。
 Ⅱ.(8分)在“验证机械能守恒定律”的实验中:
Ⅱ.(8分)在“验证机械能守恒定律”的实验中:
①某同学用图15甲所示装置进行实验,得到如图15乙所示的纸带,测出点A,C间的距离为14.77cm,点C,E间的距离为16.33cm,已知当地重力加速度为9.8m/s2,重锤的质量为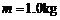 ,则重锤在下落过程中受到的平均阻力大小
,则重锤在下落过程中受到的平均阻力大小 。
。
②某同学上交的实验报告显示重锤增加的动能略大于重锤减少的重力势能,则出现这一问题的原因可能是 (填序号)。A.重锤的质量测量错误
B.该同学自编了实验数据
C.交流电源的频率不等于50HZ
D.重锤下落时受到的阻力过大
33.(15分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
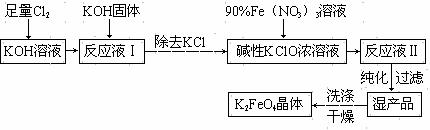
已知:① 2KOH + Cl2 = KCl + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 = 5KCl + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
⑴ 该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行。
⑵ 写出工业上制取Cl2的化学方程式 。
⑶ 配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g / mL),它的物质的量浓度为 。
⑷ 在“反应液I”中加KOH固体的目的是 (填字母)。
A. 与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B. KOH固体溶解时会放出较多的热量,有利于提高反应速率
C. 为下一步反应提供反应物
D. 使副产物KClO3转化为 KClO
⑸ 从“反应液II”中分离出K2FeO4后,会有副产品 (写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途 。
32.(17分)氮化铝(AlN)具有耐高温、抗冲击,导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
 Al2O3
+ N2 + 3C 2AlN
+ 3CO
Al2O3
+ N2 + 3C 2AlN
+ 3CO
⑴ 该反应中的还原剂是 ,其氧化产物是 。
⑵ 该反应的平衡常数表达式为K = 。
⑶ 上述反应过程中的能量变化如图
所示,该反应的△H = kJ·mol-1;
升高温度,其平衡常数值 (填
“增大”、“减小”或“不变”)。
 ⑷ 在上述反应体系中加入催化剂对
⑷ 在上述反应体系中加入催化剂对
反应热是否有影响。 ,原因是
。
⑸ 在上述反应体系中加入催化剂,反
应速率增大,E1和E2的变化是:E1 ,E2 (填“增大”、“减小”或“不变”)。
⑹ 若已知N2消耗速率为υ(N2)= 6 mol·L-1·min-1,则CO生成速率为υ(CO)=
mol·L-1·min-1。
31.(15分) W、X、Y、Z 4种短周期元素在元素周期表中的
位置如右图所示,其中Z位于ⅦA族。请回答下列问题。
⑴ W的原子结构示意图为 。Z的气态氢化物
稳定性比X的气态氢化物 (填“强”或 “弱”)。
⑵ 比较W与Y的原子半径大小为 > (填写元素符号)。
⑶ 电解NaZ水溶液时,阴极的电极反应式为 。
⑷ 已知:298 K时,金属钠与Y2气体反应,生成1 mol Na2Y固体时,放出热量414 kJ;生成1 mol Na2Y2固体时,放出热量511 kJ。由Na2Y固体与Y2气体反应生成Na2Y2固体的热化学方程式为 。
⑸ 已知化合物As2Y3在稀硫酸溶液中可被金属锌还原为AsH3,产物还有ZnSO4和H2O,该反应的化学方程式是 。
30. (17分)Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表)。设计如下对比实验。
⑴ 请完成以下实验设计表(表中不要留空格)。
|
实验 序号 |
实验目的 |
T / K |
pH |
c / 10-3 mol·L-1 |
|
|
H2O2 |
Fe2+ |
||||
|
① |
为以下实验 作参照 |
298 |
3 |
6.0 |
0.30 |
|
② |
探究温度对降解 反应速率的影响 |
|
|
|
|
|
③ |
|
298 |
10 |
6.0 |
0.30 |

[数据处理]实验测得p-CP的浓度随
时间变化的关系如图。
⑵ 请根据如图实验①曲线,计算降解
反应在50 s - 150 s内的反应速率:
v(p-CP)= mol·L-1·s-1。
[解释与结论]
⑶ 实验①、②表明温度升高,降解反
应速率增大。但温度过高时反而导致降解反
应速率减小,请从Fenton法所使用试剂H2O2的角度分析原因: 。
⑷ 实验③得出的结论是:pH =10时, 。
[思考与交流]
⑸ 实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来,根据上图中信息,给出一种迅速停止反应的方法: 。
|
W |
|
Y |
|
|
|
X |
|
Z |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com