
1.根据上图,写出生产纯碱的化学方程式
4.氨碱法制纯碱的优点是 ,
缺点是 。
3.思考与交流
(1)
|
|
将2ml NH4HCO3和2ml饱和食盐水混合、振荡 |
|
现象 |
|
|
反应方程式 |
|
(2)用食盐水洗涤煤气(废水中含氨和二氧化碳)时,可能会有白色沉淀,请用化学方程式表示 、
。
(3)氨碱法中加入氨的主要作用是什么?
2.制取碳酸钠的反应方程式是 。
氨碱法是由比利时人 发明的,氨碱法是以 和 为原料生产碳酸钠的过程。
1.生产碳酸氢钠和氯化铵的主要反应方程式是 、
。
5、合成氨工业中,原料气(N2、H2及CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(1)溶液来吸收原料中的CO,其反应是
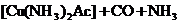

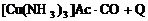
(1)必须除去原料气中CO的原因是____________________________。
(2)醋酸二氨合铜(1)吸收CO的生产适宜条件是_______________________。
(3)吸收CO后的醋酸铜氨液经过适当处理又可再生,恢复其吸收CO的能力以循环使用,醋酸铜氨液再生的生产适宜条件是______________________。
答案:(1)CO可引起催化剂(铁触媒)的中毒,故要除去。
(2)题给信息方程式是一个气体体积减小的放热反应,为使醋酸二氨合铜(I)更好的吸收CO,即平衡向正反应方向移动,适宜条件应是低温、加压。
(3)醋酸铜氨液再生,即平衡向逆反应方向移动,适宜的条件应是高温、低压。
4、在密闭容器中,反应3A2(g) 2A3(g)达到平衡,当升高温度后容器内混合气体总的物质的量减少,则逆反应是_______反应(填“放热”或“吸热”),升温前后容器内气体的原子总数___________(填“增多”、“减少”或“不变”)。
2A3(g)达到平衡,当升高温度后容器内混合气体总的物质的量减少,则逆反应是_______反应(填“放热”或“吸热”),升温前后容器内气体的原子总数___________(填“增多”、“减少”或“不变”)。
答案:放热、不变
3、下列关于催化剂的说法,正确的是
A.催化剂能使不起反应的物质发生反应
B.在化学反应前后催化剂性质和质量都不改变
C.催化剂能改变化学反应速率
D.在化学反应过程中,催化剂质量和化学性质都不变
答案:B、D
2、反应 2A(g) + B(g)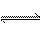 2C(g);△H > 0 。下列反应有利于生成C的是:( )
2C(g);△H > 0 。下列反应有利于生成C的是:( )
A. 低温、低压 B. 低温、高压 C. 高温、高压 D. 高温、低压
答案:C
1、一定条件下,合成氨气反应达到平衡时,测得混合气体中氨气的体积分数为20.0% ,与反应前的体积相比,反应后体积缩小的百分率是( )
A.16.7% B.20.0% C.80.0% D.83.3%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com