
2.理解接触氧化反应条件的选择原理,加深对化学反应速率和化学平衡知识的理解。
1.掌握接触法制硫酸的化学反应原理,并了解其生产过程和几个典型设备。
19.(1)BaCl2或Ba(OH)2溶液;取和量溶液乙,再滴加少量Na2SO4和H2SO4,如果出现
沉淀,说明A试剂已过量
(2)盐酸;溶解BaSO4
(3)BaSO3及BaSO4;BaSO4
(4)BaSO3+2H-=Ba2++H2O+SO2↑
第三课时 接触法制硫酸
[考纲要求]
18.(1)70%的H2SO4;新开封的无水Na2SO3;
Na2SO3+H2SO4 =Na2SO4+SO2↑+H2O
(2)2H2S+SO2=3S+2H2+2H2O
(3)25%H2SO4;FeS;FeS+2H+=Fe2++H2S↑
(4)SO2+2OH-=SO32-+H2O
(5)吸收多余的SO2防止污杂空气;防止NaOH溶液倒吸至B中,起保护作用
17.(1)Cu2++Fe =Cu+Fe2+ 2H++Fe =Fe2++H2↓
(2)0.6m(或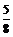 m);(但写成
m);(但写成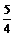 m,只得一半分)
m,只得一半分)
16.①2HSO4-+Ba2++2OH- = 2H2O+BaSO4↓+SO42-
或2H++SO42-+B2+ +2OH-= 2H2O+BaSO4 ↓
但写成H++Ba2++OH- = H2O+BaSO4 ↓为错误
②Ba2++SO42- = BaSO4↓
11.C 12.BC 13.C 14.B 15.A
1. AC 2.D 3.A 4.C 5.D 6.BC 7.B D 8.D 9.A 10.A D
19、用图3-5所示的实验过程,测定含Na2SO3的亚硫酸钠中Na2SO3的质量分数(Na:23克/摩;Ba:137克/摩;S:32克/摩).
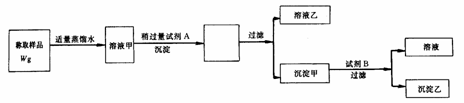
图3-5
测定沉淀乙(纯净干燥)的质量W1g,试回答:
(1)试剂A溶液是 ,检验A稍过量的方法是 ;
(2)试剂B溶液是 ,B的作用是 ;
(3)沉淀甲的化学式是 ,沉淀 乙的化学式是 ;
(4)沉淀甲与B反应的离子方程式是 ;
第二课时 硫 硫酸
[例题解析]1.B 2.(m/56)22.4L
[考题再现]1.0.5mol 2.7:1
[针对训练]
18. 下图是有关硫及其化合物的实验装置:
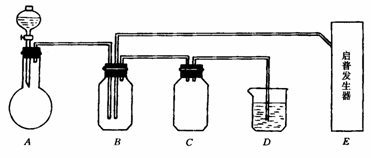
实验中用到的实验试剂在下列中选择:①浓硫酸;②70%硫酸;③25%硫酸;④新开封的亚硫酸钠粉末;⑤硫化亚铁;⑥氢氧化钠溶液;⑦溴水;⑧碳酸钠溶液.
在实验开始不久即在B瓶中析出固体粉末状物质.试回答:
(1)A中分液漏斗盛放的试剂是 平底烧瓶中盛有的试剂是 .其中在实验时反应的化学方程式为 .
(2)B中的化学方程式是 ,反应的氧化产物和还原产物的物质的量比是 .
(3)E(启普发生器)中盛有的两种试剂及发生反应的离子方程式是:试剂 ,反应: .
(4)如果A、E两装置气体发生速度相同,流量也相同时,在D中反应的离子方程式是
.
(5)D的作用是 ,C的作用是 .
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com