
1.设集合A=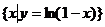 ,集合B=
,集合B= 则A
则A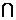 B=
( )
B=
( )
A.[0,1] B. C.
C. D.
D.
20.(14分)铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
|
编号 |
猜
想 |
|
甲 |
溶液中的+3价Fe又被还原为+2价Fe |
|
乙 |
溶液中的SCN-被过量的氯水氧化 |
|
丙 |
新制的氯水具有漂白性,将该溶液漂白 |
(1)试剂1是 ,加入新制氯水后溶液中发生的离子反应方程式是:
, ;
(2)加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了淡红色,其可能的原因是 ;
(3)在实验中发现放置一段时间,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确。写出有关的实
验操作、预期现象和结论。(不一定填满,也可以补充)
|
编号 |
实验操作 |
预期现象和结论 |
|
① |
|
|
|
|
|
|
19.(16分)化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol·L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好。(已知2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O)

(1)e处反应的离子方程式为_______________________________。该反应中氧化剂和还原剂的物质的量之比_______________________。
(2)b处的实验现象:_______________ _________________________________
d处的实验现象________________ _________________________________
(3)c处反应的化学方程式为________________________________。标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为________mol。
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?________(填“能”或“不能”),若能,其氧化性由强到弱的顺序是_ ___________________

18.(10分)现有下列8种物质:①Na2CO3、②NaHCO3、③C6H5ONa、④NH4HCO3、⑤C2H5OH、⑥Al、⑦食盐水、⑧CH3COOH。
(1)上述物质中属于强电解质的是________(填序号),既能跟盐酸反应又能跟NaOH溶液反应的是________(填序号)。
(2)上述②的水溶液呈碱性的原因是(用离子方程式表示)__________________。
(3)④跟足量的NaOH浓溶液在加热条件下反应的离子方程式是__________。
17.(12分)实验室需要0.1 mol/L NaOH溶液450 mL和0.5 mol/L硫酸溶液450 mL。
根据这两种溶液的配制情况回答下列问题:
(1)根据计算用托盘天平称取NaOH的质量为 g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度 0.1 mol/L(填“大于”、“等于”或“小于”,下同)。若NaOH在溶解后未冷却到室温,便注入容量瓶内并定容,则所得溶液浓度 0.1 mol/L。
(2)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为 ______mL(计算结果保留一位小数)。如果实验室有15 mL、20 mL、50 mL量筒,应选用 mL量筒最好。
配制过程中量取过浓硫酸的量筒,用水洗涤并将洗涤液注入容量瓶内,则所配溶液的物质的量浓度会 (填“偏大” “偏小”“ 无影响”)
16.在三个密闭容器中分别充入N2、H2、O2三种气体,在以下各种情况下排序正确的是
( )
A.当它们的体积和温度、压强均相同时,三种气体的密度ρ(H2)>ρ(N2)>ρ(O2)
B.当它们的温度和密度都相同时,三种气体的压强p(H2)>p(N2)>p(O2)
C.当它们的质量和温度、压强均相同时,三种气体的体积V(O2)>V(N2)>V(H2)
D.当它们的压强和体积、温度均相同时,三种气体的质量m(H2)>m(N2)>m(O2)
第Ⅱ卷 (非选择题,共52分)
15.黄磷(P4)与浓氢氧化钾溶液反应的化学方程式为:P4+3KOH+3H2OPH3↑+3KH2PO2,被氧化的P与被还原的P的质量之比为 ( )
A.1:2 B.2:1 C.3:1 D.1:3
14.有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl 离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为 ( )
离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为 ( )
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
13.在一定条件下,RO3n-与氟气可发生如下反应:RO3n- + F2 + 2OH- = RO4- + 2F- + H2O
从而可知在RO3n-中,元素R的化合价是 ( )
A.+4 B.+5 C.+6 D.+7
12.在下列给定条件的溶液中,一定能大量共存的离子组是 ( )
A.无色溶液:Ca2+、H+、Cl-、HSO3-
B.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
C.碱性溶液中:K+、HCO3-、SO、AlO2-
D.=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com