
6.(2005江苏)(10分)水垢可以看作由多种物质组成的混合物,为研究含有Ca2+、Mg2+、HCO3的水所形成的水垢的化学组成,取干燥的水垢6.32 g ,加热使其失去结晶水,得到5.78 g 剩余固体A;高温灼烧A至恒重,残余固体为CaO和MgO,放出的气体用过量的Ba(OH)2溶液吸收,得到的11.82 g 沉淀。
(1)通过计算确定A中是否含有碳酸镁;
(2)5.78 g 剩余固体A灼烧至恒重时产生的气体完全被碱石灰吸收,碱石灰增重2.82 g ,通过计算确定A中各成分的物质的量,并计算出水垢中碳酸盐质量分数。
5.(2005广东)(12分)钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的
白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿矿储量居世界首位。含有Fe2O3的钛
铁矿(主要成分为FeTiO3)制取TiO2的流程如下:
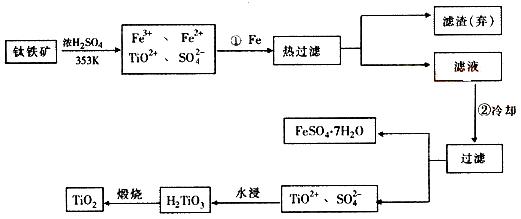
⑴ Ti的原子序数为22,Ti位于元素周期表中第_______周期,第______族。
⑵ 步骤①加铁的目的是____________________________________________________;
步骤②冷却的目的是____________________________________________________。
⑶ 上述制备TiO2的过程中,可以利用的副产物是___________;考虑成本和废物综合利用因素,废液中应加入_________________处理。
⑷ 由金红石(TiO2)制取单质Ti,涉及到的步骤为:
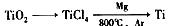
已知:① C(s) + O2(g) == CO2(g); △H = -393.5 KJ/mol
② 2CO(g) + O2(g) == 2CO2(g); △H = -566 KJ/mol
③ TiO2(s) + 2Cl2(g) == TiCl4(s) + O2(g); △H = +141 KJ/mol
则TiO2(s) + 2Cl2(g) + 2C(s)== TiCl4(s) + 2CO(g) 的△H = _________________。
反应TiCl4 + 2Mg == 2MgCl2 + Ti 在Ar气氛中进行的理由是________________________。
4.(2005江苏)某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的是离子组是
A、K+、Na+、HCO3-、NO3- B、Na+、SO42-、Cl-、ClO-
C、H+、Mg2+、SO42-、NO3- D、Ag+、K+、NO3-、Na+
3. (2005江苏)氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子
工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C 2AlN+3CO,下列叙述正确的是
2AlN+3CO,下列叙述正确的是
A、在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B、上述反应中每生成2mol AlN,N2得到3mol电子
C、氮化铝中氮元素的化合价为-3价
D、氮化铝晶体属于分子晶体
2.(2005广东综合)下列反应的现象描述与离子方程式都正确的是
A.金属镁与稀盐酸反应,有氢气产生:Mg + 2H++ 2Cl- == MgCl2 + H2↑
B.氯化钡溶液与硫酸反应,有白色沉淀产生;Ba2+ + SO42- == BaSO4↓
C.碳酸钠溶液与盐酸反应,有气泡逸出;Na2CO3 +2H+ == 2Na+ + H2O + CO2↑
D.过量铁粉与氯化铁溶液反应,溶液变浅绿色;Fe + Fe3+ == 2Fe2+
1.(2005广东)铊(Tl)是某超导材料的组成元素之一,与铝同族,位于第6周期。Tl3+与Ag在酸性介质中发生反应:Tl3++ 2Ag ==Tl+ + 2Ag+。下列推断正确的是
A.Tl+ 的最外层有1个电子 B.Tl3+ 的氧化性比Al3+弱
C.Tl能形成+3价和+1的化合物 D.Tl+ 的还原性比Ag强
7、关于KAl(SO4)2和Ba(OH)2反应的原理及图象:
(1)沉淀物质的量变化图象 (2)沉淀质量变化图象
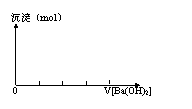
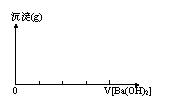
沉淀物质的量最大时反应的化学方程式 沉淀质量最大时反应的化学方程式
课后练习
6、向含等物质的量的Al3+、Mg2+的溶液中先加入NaOH,再加稀盐酸
实验现象:
 离子方程式:
离子方程式:
5、 AlCl3、MgCl2溶液中加过量的NaOH溶液
AlCl3、MgCl2溶液中加过量的NaOH溶液
实验现象:
离子方程式:
4、 AlO2-与强酸反应
AlO2-与强酸反应
(1)向NaAlO2溶液中逐滴滴入稀盐酸至过量:
实验现象:
离子方程式:
(2)向稀盐酸中逐滴滴入偏铝酸钠溶液至过量:
实验现象:
离子方程式:
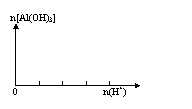
(3)向含有NaOH的NaAlO2溶液中逐滴滴入稀盐酸至过量:
实验现象:
离子方程式:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com