
15.离子晶体
14. 2
13.②>③>①
1.D 2.B 3.C 4.B 5.D 6.BD 7.AB 8.D 9.A 10.C 11.A 12.C
18.参考上题中NaCl的晶胞结构计算:(1)每个晶胞中平均分______个Na+,______个Cl-。
(2)若某NaCl晶体的质量为5.85g,计算所含NaCl晶胞的物质的量。
第2节 金属晶体与离子晶体答案
17.纳米材料的表面微粒数占总微粒数的比例极大,这是它具有许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状(如下图所示)相同,则这种纳米颗粒的表面微粒数点总微粒数的百分数为 ( )
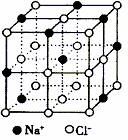
A.87.5% B.92.9% C.96.3% D.100%
16.萤石(CaF2)晶体属于立方晶系,萤石中每个Ca2+被8个F-所包围,则每个F-周围最近距离的Ca2+数目为 ( )
A.2 B.4 C.6 D.8
15.BaCl2是无色晶体,熔点963℃,沸点1560℃,溶于水,水溶液能导电。它可能属于________________晶体。
[探索提高]
14.金属钾晶体为体心立方结构,则在单位晶胞中钾原子的个数是 。
13.离子键的强弱主要决定于离子半径和离子电荷值,一般规律是:离子半径越小,离子电荷值越大,则离子键越强。试分析:①Na2O、② Al2O3、③MgO三种物质离子键由强至弱的顺序是(填序号)_____________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com