
17.(12分)下表是元素周期表的一部分,表中字母分别代表某一化学元素。
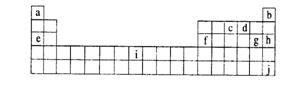 (1)a、e属于同一主族,可否组成化合物,
若能写出它的化学式__________,电子式
,其化学键的类型是
(1)a、e属于同一主族,可否组成化合物,
若能写出它的化学式__________,电子式
,其化学键的类型是
 21世纪教育网
21世纪教育网
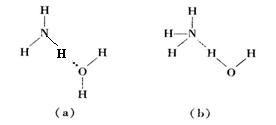 (2)NH3·H2O的电离方程式为 NH3·H2O
(2)NH3·H2O的电离方程式为 NH3·H2O
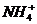 +
+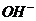 ,试判断溶于水后,形成的合理结构是________。(填右图中的字母)
,试判断溶于水后,形成的合理结构是________。(填右图中的字母)
(3)在一定体积的容器中,加入1.5摩j的气体单质和7.5摩氟气,于400℃和2633千帕压强下加热数小时,然后迅速冷却至25℃,容器内除得到一种无色晶体外,还余下4.5摩氟气。则所得无色晶体产物中,氙与氟的原子个数比是______,化学式为 。
16. (8分)氮可以形成多种离子,如
(8分)氮可以形成多种离子,如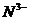 ,
,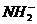 ,
,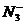 ,
,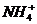 ,
,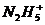 ,
,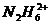 等,已知
等,已知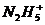 与
与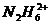 是由中性分子结合质子形成的,类似于
是由中性分子结合质子形成的,类似于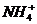 ,因此有类似于
,因此有类似于
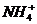 的性质。
的性质。
(1)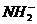 的电子式为
。 (2)
的电子式为
。 (2)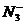 有
个电子。
有
个电子。
(3)写出两种由多个原子组成的含有与N3-电子数相同的物质化学式 。
 (4)等电子数的微粒往往具有相似的结构,预测N3-的最可能构型
。
(4)等电子数的微粒往往具有相似的结构,预测N3-的最可能构型
。
15.已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如下图,则下列判断错误的是 ( )
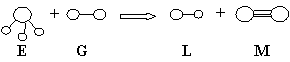

A.G是最活泼的非金属单质 B.M化学性质活泼
C.E能使紫色石蕊试液变蓝色 D.L是极性分子
14.下列物质性质的变化规律与分子间作用力有关的是 ( )
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.金刚石的硬度大于硅,其熔、沸点也高于硅
C.NaF、NaCl、NaBr、NaI的熔点依次降低
D.F2、Cl2、Br2、I2的熔、沸点逐渐升高
13. 根据等电子原理,由短周期元素组成的粒子,只要其电子总数相同,均可互称为等电子体。等电子体之间结构相似、物理性质也相近。以下各组粒能互称为等电子体的是
( )
A.O3和SO2 B.CO和N2 C.CO和NO D.N2H4 和C2H4
12.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是 ( )
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变。
B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+。
C.硫酸铜水溶液里加入氨水生成的沉淀是氢氧化铜,继续加氨水沉淀又溶解,说明氢氧化铜是两性氢氧化物。
D.在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道。
11.下列叙述中错误的是 ( )
A.离子键没有方向性和饱和性,共价键有方向性和饱和性
B.配位键在形成时,由成键双方各提供一个电子形成共用电子对
C.金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用
D.金属键中的“自由电子”为金属阳离子共用
10.下列事实与氢键有关的是 ( )
 A.水加热到很高温度都难以分解 B.水结成冰体积膨胀,密度变小
A.水加热到很高温度都难以分解 B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.NH3的热稳定性比PH3强
9.已知NH3分子可与Cu2+形成配位化合物离子[Cu(NH3)4] 2+, 则除去硫酸铜溶液中少量硫酸可选用的试剂是 ( )
A.NaOH B.NH3 C.BaCl2 D.Cu(OH)2
8.已知A+、B2+、C-、D2-四种离子具有相同的电子层结构。现有以下排列顺序:
①B2+>A+ > C->D2-、 ②C->D2->A+>B2+、 ③B2+>A+>D2->C-、④D2->C->A+>B2+ 。四种离子的半径由大到小以及四种元素原子序数由大到小的顺序分别是 ( )
A.①④ B.④① C.②③ D.③②
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com