
9.D 10.B 11.B 12.B 13.B 14. D 15.B
3、(1)1s22s22p63s23p63d9 (2)孤对电子(孤电子对)(3)b (4)Si < C <N
(5) 3:2 (6)原子晶体
¤参悟经典习题
2、D
1. D
D
4.A
¤知识动脉
例1.C
变式训练1.C
例2.B
变式训练2.D
 例3.A
例3.A
 变式训练3.BC
变式训练3.BC
例4.A
例5.A
例6.A
变式训练6.A
例7.π键比σ键稳定
变式训练7
解析:由已知条件可推知:D为C,E为N,X为Si,Y为S,Z为Cl。
答案:(1)SO3。
(2)Cl;HClO、HClO2、HClO3、HClO4。
(3)直线型。
(4)共价键;原子晶体。
(5)Mg3N2;Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑。
(6)D的最高价氧化物为CO2,X的最高价氧化物为SiO2,前者比后者的熔点低,因为前者为分子晶体,由分子间的作用力结合,而后者为原子晶体,由共价键结合,共价键之间的作用力远大于分子间的作用力 21世纪教育网
21世纪教育网
¤感悟高考真题
2.B
3.B
1.B
20. (12分)2005年12月2日新浪网报道,我国独立研制的具有自主知识产权的“龙芯2D”12月底完成流片。“龙芯2D”的面世,意味着中国在半导体产业上已取得了长足进步,同时将有着良好的发展前景。
(12分)2005年12月2日新浪网报道,我国独立研制的具有自主知识产权的“龙芯2D”12月底完成流片。“龙芯2D”的面世,意味着中国在半导体产业上已取得了长足进步,同时将有着良好的发展前景。
试回答下列问题:
(1)“龙芯”(芯片)的主要成分是单晶硅,硅位于元素周期表中第____周期____族;
(2)硅在一定条件下可以与氯气反应生成SiCl4,与氧气反应生成SiO2。四氯化硅结构中,所有原子最外层 (填“是、否”)都满足8电子稳定结构。用电子式表示四氯化硅的形成过程 21世纪教育网
21世纪教育网
(3)试判断SiCl4的沸点比CCl4的 (填“高或低”),理由
。若已知CCl4比SiCl4稳定,则C-Cl键的键能比Si-Cl键的键能 (填大、小)。
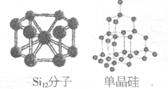 (4)现在新开发出一种具有和“龙芯”主要成分一样的六角形笼状结构单质分子Si12,它可能在未来的量子计算机中是一个理想的贮存信息的材料,根据下图推断这种六角形笼状结构:它与单晶硅(参照右图)互称为
,硅原子之间是通过
键结合的
(4)现在新开发出一种具有和“龙芯”主要成分一样的六角形笼状结构单质分子Si12,它可能在未来的量子计算机中是一个理想的贮存信息的材料,根据下图推断这种六角形笼状结构:它与单晶硅(参照右图)互称为
,硅原子之间是通过
键结合的 21世纪教育网
21世纪教育网

¤课前小练:
19.(10分)在一定条件下,某元素的氢化物X可完全分解为两种单质Y和Z。已知:
①反应前的X与反应后生成的Z的物质的量之比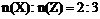
②单质Y的分子为正四面体构型 21世纪教育网
21世纪教育网
请填写下列空白 21世纪教育网
21世纪教育网
(1)单质Y是___________,单质Z是___________(填分子式)。
 (2)1个Y分子中共含___________个共价键。键角是
。
(2)1个Y分子中共含___________个共价键。键角是
。
(3)X分解为Y和Z的化学方程式为: 。
18.(13分)已知X、Y、Z、W是短周期中四种非金属元素,它们的原子序数依次增大。X元素原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
(1)写出元素符号:X ;Y ;Z ;W 。
(2)X单质和Z单质在一定条件下反应生成化合物E, E分子的空间构成型为 ,分子的极性为 。
(3)这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序),
该化合物的化学式为
,它含有的化学键类型有_______键、_________ 键和_________键 21世纪教育网
21世纪教育网
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com