
5、将Na2CO3•10H2O和小苏打的混合物7.4克溶于水制成溶液100ml,测得的C(Na+)为0.6mol/L,若将同质量的该化合物加热到恒重,则混合物质量会减少
A. 2.12克 B. 3.18克 C. 4.22克 D. 5.28克
4、0.1摩Na2O2、Na2O的混合物溶于水后,刚好被100克7.3%的盐酸中和.则混合物中
Na2O2和Na2O的物质的量之比为( )
A. 1:1 B. 2:1 C. 任意比 D. 3:4
3、有50毫升某气体,可能含有CO2、O2、NH3等气体,将其通过浓硫酸没有发现体积变化,通过足量Na2O2后,体积变为30毫升,则该气体的组成为( )
A. CO2为20毫升,NH3为30毫升 B. NH3为40毫升,O2为10诧升
C. CO2为30毫升,O2为20毫升 D. CO2为40毫升,O2为10毫升
2、钡和钠相似,也能形成含O22-离子的过氧化物。下列叙述中正确的是 ( )
A. 过氧化钡的化学式为Ba2O2 B.O22- 离子的电子式为[O:O]2-
C. 1mol过氧化钠或过氧化钡跟足量水反应都生成0.5molO2
D. 过氧化钠或过氧化钡都可做氧化剂
1、能从水溶液中还原出6摩H+的是( )
A.2molFe B.6molOH- C.6molI- D. 6molNa
2、钠的其他化合物
(1)氢氧化钠
NaOH是一种 色固体,易 ,有 性。俗名有 、
。为一元强碱,具有碱的通性。
例如:
(1)C6H5OH +NaOH-
(2)P2O5+NaOH-
(3)Cl2+NaOH-
(4)Al2O3+NaOH-
(5)Al(OH)3+NaOH-
(6)NH4++OH--
(7)H2PO4- + OH--
(8) CH3CH2Br + NaOH(醇)-
(2)Na2CO3和NaHCO3的比较
|
化学式 |
Na2CO3 |
NaHCO3 |
|
俗名 |
|
|
|
色态 |
|
|
|
溶解性 |
|
|
|
与酸反应及速率快慢 |
|
|
|
热稳定性 |
|
|
|
同温、同物质的量浓度 的水溶液碱性 |
|
|
|
相互转化 |
 |
典型例题
例1: 2.3g金属钠放入97.7g水中所得溶液的质量分数为( )
A.2.3% B.4% C.<4% D.>4%
解:溶液为NaOH,其质量为4g。其产生H2。溶液质量小于100g.
答案:D
例2:把ag Na2O和a1g Na2O2分别加入等质量的bg水中(足量),结果得到同浓度的溶液,则a、a1的关系是_________
解:常规方法:
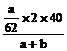 =
=
62a1=78a
 =
= .
.
技巧
Na2O+H2O=2NaOH
1 mol 2 mol
Na2O2+H2O=2NaOH+ O2
O2
1 mol 2mol  mol
mol
1mol Na2O2比1mol Na2O多1molO,与H2O反应时多余的O以O2形式放出.
结论:等物质的量的Na2O和Na2O2与等量且足量的水反应,得到同浓度的溶液.
本题:n =n
=n
 =
= =
=
当堂反馈
1、氧化钠和过氧化钠的比较
|
|
氧化钠(Na2O) |
过氧化钠(Na2O2) |
|
颜色状态 |
|
|
|
电子式 |
|
|
|
是否碱性氧化物 |
|
|
|
氧元素化合价 |
|
|
|
生成条件 |
|
|
|
稳定性 |
|
|
|
所含键型 |
|
|
|
跟水反应 |
|
|
|
跟CO2反应 |
|
|
|
跟酸反应 |
|
|
|
用途 |
|
|
|
转化关系 |
2Na2O + O2 === 2Na2O2 |
4、钠的取用
在实验室里,有一瓶浸在煤油里的钠块。要取用金属钠进行实验,取用的操作方法是
。
3、钠的存在、保存和用途
(1)自然界里的元素有二种存在形态:一种的单质的形态存在,叫做 态;一种以化合物的形态存在,叫做 态。钠只以 态存在,如:自然界中的 、
、 、 、 等。
(2)金属钠必须 保存,通常保存在 里。 (填“能”、“不能”)保存在CCl4中。
(3)钠可以用来制取 等化合物;钠钾合金是 的导热剂;钠是一种强还原剂冶炼
;钠也用在 上。
2、钠的化学性质
(1)钠元素位于第 周期 族;钠原子最外电子层上有 个电子,在化学反应中很 失去电子。因此,钠的化学性质 活泼。
(2)
|
钠的化学性质 |
化学方程式 |
现象 |
|
与非金属反应:如O2 |
|
|
|
与H2O的反应(加酚酞) |
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com