

29.(1)注视 锥形瓶内溶液颜色的变化 (2分) 。直到 因加入1滴标准液而使溶液由红色变为无色并在30s内不恢复 为止。 (2分)
(2)偏低的是 D (2分)
(3) (每空各1分)
|
滴定次数 |
待测氢氧化钠溶液的体积/ mL |
0.1000
mol/L 盐酸的体积/ mL |
||
|
滴定前刻度 |
滴定后刻度 |
溶液体积/ mL |
||
|
第一次 |
25.00 |
0.00 |
26.10 |
26.10 |
|
第二次 |
25.00 |
1.56 |
28.08 |
26.52 |
|
第三次 |
25.00 |
0.22 |
26.34 |
26.12 |
(4)c(NaOH)= 0.1044mol/L 。(3分)
29.某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________________。直到____________________________为止。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________。
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的空白处。
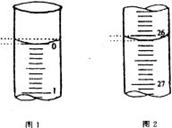
|
滴定次数 |
待测氢氧化钠溶液的体积/ mL |
0.1000
mol/L 盐酸的体积/ mL |
||
|
滴定前刻度 |
滴定后刻度 |
溶液体积/ mL |
||
|
第一次 |
25.00 |
|
|
|
|
第二次 |
25.00 |
1.56 |
28.08 |
26.52 |
|
第三次 |
25.00 |
0.22 |
26.34 |
26.12 |
(4)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= __。
 哈师大附中高二上学期期中考试化学试题答题纸
哈师大附中高二上学期期中考试化学试题答题纸
28.(1)某温度时,测得0.01mol/L的NaOH溶液的pH为11,则该温度下水的离子积KW = 。
(2)在此温度下,将pH = a 的NaOH溶液Va L与pH = b 的硫酸Vb L混合。
①若所得混合液为中性,且a=12,b=2,则Va :Vb = ;
②若所得混合液pH = 10,且a=12,b=2,则Va :Vb = 。
27.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题: (1)该反应的化学平衡常数表达式为K= ; (2)该反应为 反应(选填吸热、放热); (3)某温度下,平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为 ℃;
(4)830℃时,向该容器中加入1L CO2与1L H2 ,平衡时CO2的体积分数是 。
26.可逆反应: 2 A(g) + B(g)
 3 C(s)
+ D(g)。试根据下图回答:
3 C(s)
+ D(g)。试根据下图回答:
 A%
A%



 P1
P1 

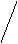
 P2 T1℃
P2 T1℃
 T2℃
T2℃

 t/s
t/s
t/s
t/s
甲
乙 
(1)温度T1℃ 比 T2℃_____(填高、低);
该反应的正反应为_____热反应(填吸、放);
(2)甲图纵轴可以表示________ (填序号)。
① A的转化率 ②B的物质的量 ③C的百分含量 ④混合气体的总质量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com