
6.欲除去SiO2中混有的少量CaCO3和Fe2O3,最好应加入的试剂是
A.硫酸 B.烧碱
C.氢氟酸 D.盐酸
5.下列各组物质的比较中,正确的是
A.熔点:晶体硅>碳化硅>金刚石
B.金属活动性:锗>锡
C.稳定性:CH4>SiH4
D.酸性:H2SiO3>H2CO3
4.将过量的CO2通入下列溶液中,最终出现浑浊的是
A.CaCl2溶液 B.石灰水
C.饱和Na2CO3溶液 D.水玻璃
3.2MgO·SiO2中的酸根离子是
A.SiO B.Si2O
B.Si2O
C.SiO D.SiO
D.SiO
2.实验室存放下列各试剂的瓶塞必须用橡皮塞的是
A.澄清石灰水 B.硅酸钠溶液
C.新制氯水 D.氯化钙溶液
1.(2002年全国高考题)以下说法正确的是
A.纳米材料是指一种称为“纳米”的新物质制成的材料
B.绿色食品是指不含任何化学物质的食品
C.生物固氮是指植物通过叶面吸收空气中的氮气
D.光导纤维是以二氧化硅为主要原料制成的
4.实战演练
3.例题精讲
[例1] 熔融氢氧化钠反应选用的器皿是 [ ]
|
A.陶瓷坩埚 |
B.石英坩埚 |
|
C.普通玻璃坩埚 |
D.生铁坩埚 |
分析:陶瓷的成分中含有SiO2,石英的成分就是SiO2,玻璃的主要成分中也含有SiO2,而SiO2在高温下可以跟NaOH发生如下反应:
SiO2+2NaOH Na2SiO3
Na2SiO3
所以A、B、C的器皿都不能选用,只能内生铁坩埚。
答案:D
[例2] 下列溶液中可以盛放在玻璃瓶中,但不能用磨口玻璃塞的是 [ ]。
|
A.硅酸钠溶液 |
B.氢氟酸 |
|
C.氢氧化钠溶液 |
D.氯化钠溶液 |
分析:玻璃的主要成分之一二氧化硅,它能跟氢氟酸迅速反应,所以,氢氟酸不能盛放在玻璃、陶瓷容器中,只能保存在铅皿或塑料瓶中。氢氧化钠溶液与二氧化硅在常温下反应十分缓慢,所以可以盛放在玻璃瓶中,但瓶的磨口处的二氧化硅跟氢氧化钠缓慢反应后,生成的硅酸钠是一种矿物胶,使瓶塞与瓶口粘在一起,因此不能用磨口玻璃塞。硅酸钠溶液可以用玻璃瓶盛放,只是不能用磨口玻璃塞(原因同氢氧化钠溶液)。氯化钠溶液不跟玻璃中各种成分反应。
答案:AC
[例3] 普通玻璃的主要成分为Na2SiO3·CaSiO3·4SiO2
(1)试计算普通玻璃中相当含有Na2O,CaO和SiO2的质量分数各是多少?
(2)制造50kg普通玻璃,需要纯碱、碳酸钙和二氧化硅各多少千克?
分析:Na2SiO3·CaSiO3·4SiO2可用二氧化硅和金属氧化物的形式表示其组成为:Na2O·CaO·6SiO2。
(1)Na2O的摩尔质量为62g/mol,CaO的摩尔质量为56g/mol,SiO2的摩尔质量为60g/mol。
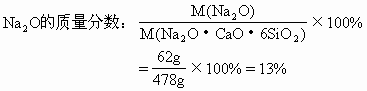
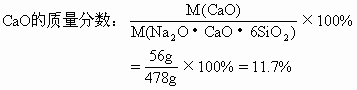
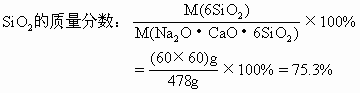
(2)由第(1)题求出普通玻璃中各氧化物的质量分数,可计算50kg普通玻璃中Na2O、CaO和SiO2的含量:
m(Na2O):50kg×13%=6.5kg
m(CaO):50kg×11.7%=5.85kg
m(SiO2):50kg×75.3%=37.65kg
再求需纯碱、碳酸钙和二氧化硅的质量:
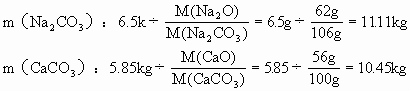
m(SiO2):37.65kg
答案:(1)普通玻璃中Na2O的质量分数为13%,CaO的质量分数为11.7%,SiO2质量分数为75.3%。
(2)制造50kg普通玻璃,需要纯碱11.11kg、碳酸钙10.45kg、二氧化硅37.65kg。
[例4] 有A、B、C三种不溶于水的固体。A是某元素的一种单质,它在氧气中完全燃烧得到一种无色气体,此气体能使澄清石灰水变浑浊,另外测得这种气体密度为同温、同压下氧气密度的1.375倍。B固体能溶于热氢氧化钠溶液,再往所得溶液中加入过量盐酸时,析出白色胶状沉淀。此沉淀干燥后,成为不溶于水的白色粉末,这是一种比碳酸酸性还弱的酸。将B与石灰石、纯碱按比例混合加热得到C,C在高温时软化,无固定熔点。
根据以上事实,判断A为哪种元素的单质?B、C各是什么物质?写出有关反应的化学方程式。
分析:先求出A燃烧后生成的气体的相对分子质量,根据该气体的相对分子质量及其反应现象可推出单质A;再根据B的有关反应现象可推出B;最后根据制取C的方法及C的性质可推出C。
A物质燃烧后生成的气体的相对分子质量为:
32×1.375=44
该气体能使澄清石灰水变浑浊,所以该气体为二氧化碳,A为碳元素的一种单质。
根据B物质能与氢氧化钠反应,且能继续与过量的盐酸反应生成一种比碳酸还弱的酸,可推出B物质为二氧化硅。
C物质由石灰石、纯碱、B物质(二氧化硅)混合加热而得,结合C物质在高温时软化且无固定熔点,可推知C物质为普通玻璃。
答案:A为碳元素的一种单质。
C+O2 CO2
CO2
B为SiO2
SiO2+2NaOH==Na2SiO3+H2O
Na2SiO3+2HCl=2NaCl+H2SiO3↓
C为普通玻璃
Na2CO3+SiO2==Na2SiO3+CO2↑
CaCO3+SiO2==CaSiO3+CO2↑
[例5] 某硅酸锌样品含58.6%的锌,而ZnO%与SiO2%的质量分数的总和为100%,写出这样品的化学式(最简式)。
分析:题目要求写出这样品的化学式(最简式),即是要求通过计算找出ZnO与SiO2的物质的量之比值,然后用SiO2和ZnO的形式表示此硅酸锌样品的组成。
可先由Zn%求算出ZnO%,并求出SiO2%。然后再运用求最简式最基本的方法求出此硅酸锌的组成。
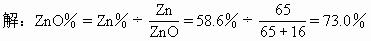
SiO2%=1-73.0%=27.0%
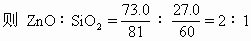
该硅酸锌样品的化学式为:2ZnO·SiO2。
[例6] 两个原硅酸分子的OH原子团之间可以相互作用而脱去一分子水:
2H4SiO4===H6Si2O7+H2O
原硅酸结构为:
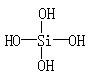
则在所得的H6Si2O7分子的结构中,含有的硅氧键数目为 [ ]
|
A.5 |
B.6 |
|
C.7 |
D.8 |
分析:此题是一道选择题,也是一道信息迁移题。给出的新情境是原硅酸结构及脱水反应,考查内容是H6Si2O7分子中的硅氧键数目。两个原硅酸共有8个硅氧键,当它们相互作用时,虽然有一个硅氧键断裂,但又形成一个新的硅氧键,如图所示:
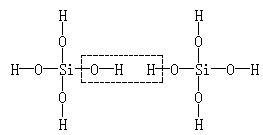
故硅氧键的总数目没有变,仍然是8个。
答案:D
[例7] 下列离子方程式书写不正确的是 [ ]
A.往NaOH溶液中通入过量CO2
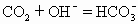
B.单质硅与烧碱溶液反应
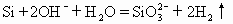
C.石英砂与烧碱反应制水玻璃
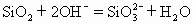
D.往水玻璃中通入二氧化碳
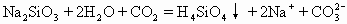
分析:往NaOH溶液中通入适量CO2生成正盐Na2CO3,正盐能与酸反应变为酸式盐,所以当CO2过量时即溶液中H2CO3过量时,生成物为NaHCO3,故A式正确。
单质硅能和烧碱溶液反应生成硅酸钠和氢气,NaOH是易溶于水的强碱,Na2SiO3。是易溶于水的盐,均完全电离,故Na+可以简化掉,B式正确。
石英的成分是二氧化硅与烧碱液发生复分解反应生成硅酸钠和水。故C式正确。
碳酸比硅酸酸性强,所以往水玻璃即硅酸钠的水溶液中通入二氧化碳可以制硅酸。反应物中的Na2SiO3和生成物中的Na2CO3均为易溶于水的盐,能完成电离写成离子式,并且Na+可以简化掉,故D式不正确。
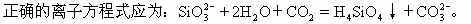
答案:D
[例8] 有一铅锡合金质量为100g,完全氧化后得到氧化物的混合物质量为116g,求合金中铅、锡的质量分数各为多少?
解法一:
分析:设100g铅锡合金中含锡xg,则含铅(100-x)g。①Sn氧化后的稳定产物是SnO2(+4价氧化物稳定),Sn的相对原子质量为

Pb氧化后的稳定产物是PbO(+2价氧化物稳定), Pb的相对原子质量为207,PbO的式量为223,(100-x)g Pb氧化生成的PbO质量必
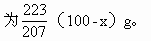
因为SnO2与PbO质量共为116g,故可列一元一次方程,解方程求出Sn、Pb质量。
[解] 设100g锡铅合金中含锡xg,含铅为(100-x)g。
根据化学式所表示的元素质量分数及题意,列代数方程式:
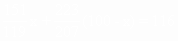
解得x=43.2(g)
100-x=100-43.2=56.8(g)
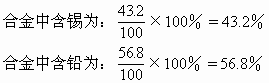
答:合金中锡、铅质量分数分别为43.2%、56.8%
解法二:
分析:此题利用物质的量计算也很方便。设100g合金中含xg,含铅为(100-x)g
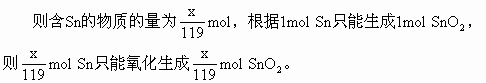
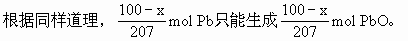
将SnO2与PbO由物质的量换算成质量,质量和为116g。
解:设100g锡铅合金中含锡为xg,含铅为(100-x)g
Sn的物质的量=SnO2的物质的量

Pb的物质的量=PbO的物质的量

SnO2与PbO质量和为116g
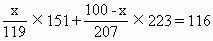
|
解得 x=43.2(g) |
(锡的质量) |
|
100-x=56.8(g) |
(铅的质量) |
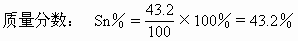
Pb%=1-43.2%=56.8%
答:合金中铅、锡分别占56.8%、43.2%
[例9] 称取两份由碳酸钠、碳酸氢钠和碳酸氢铵组成的混合物7.06g。其中:一份加入过量的盐酸,可得CO2为1792mL(在标准状况下),另一份加热至质量不再减少时为止。冷却后再跟过量盐酸反应,可得CO2为896mL(在标准状况下)。求原混合物中,碳酸钠、碳酸氢钠和碳酸氢铵的物质的量之比。
分析:此题是根据化学方程式,计算混合物成分物质的量之比的题。解题关键在于正确判断反应物与生成物、反应物的量与生成物的量之间的关系。
第一份7.06g混合物,各成分都跟过量的盐酸充分反应,均生成CO2。CO2体积之和为1792mL;第二份7.06g混合物加热后,除碳酸氢钠转化为碳酸钠外,碳酸氢铵则因全部转变为气态物质而不存在固体物质了。混合物中原有碳酸钠及生成的碳酸钠共同跟过量盐酸反应,生成896mLCO2。
解 全过程发生反应的化学方程式为:
|
Na2CO3+2HCl==2NaCl+H2O+CO2↑ |
(1) |
|
NaHCO3+HCl==NaCl+H2O+CO2↑ |
(2) |
|
NH4HCO3+HCl==NH4Cl+H2O+CO2↑ |
(3) |
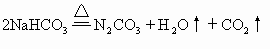 |
(4) |
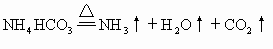 |
(5) |
设7.06g该混合物中含Na2CO3、NaHCO3、NH4HCO3分别为x、y、zmol
从化学方程式(1)(2)(3)可知,第一份7.06g混合物与过量盐酸反应,共生成CO2为(x+y+z)mol
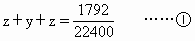
从化学方程式(4)、(5)可知,第二份7.06g混合物加热,其中
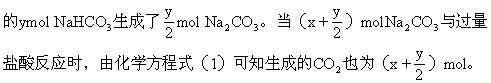

x∶y∶z=0.02∶0.04∶0.02=1∶2∶1
答:Na2CO3、NaHCO3、NH4HCO3的物质的量之比为1∶2∶1。
新型无机非金属材料
[例10] 新型无机非金属材料跟传统硅酸盐材料相比,有什么特性?
[分析] (1)能承受高温,强度高。如氮化硅陶瓷在1200℃时仍具有高强度。
(2)具有电学特性。有的可作绝缘体,有的可作半导体、导体、超导体。
(3)具有光学特性。有的能发出各色光,有的能透过可见光,有的能使红外线、雷达射线穿过。
(4)具有生物功能。有些对人体组织有较好的适应性,且硬度高、无毒、不溶于水,可直接植于人体内。
[答案] 略。
[例11] 请比较红宝石和蓝宝石成分的异同。人造红宝石和人造蓝宝石各有何用途?
[解答] 两者的主要成分都是Al2O3(刚玉)。刚玉中混有少量铬时,呈现红色,就形成红宝石;刚玉中混有少量钛时,呈现蓝色,就形成蓝宝石。
人造红宝石硬度高,可制钟表的轴承,它能放大某一波长的光而产生激光,可作固体激光器。人造蓝宝石因能使紫外线和可见光通过,可用于制造光学仪器。
[例12] 下列说法正确的是 [ ]
A.二氧化硅溶于水显酸性
B.光导纤维传导光的能力非常强,利用光缆通讯,能同时传送大量信息
C.因为高温时二氧化硅与碳酸钠反应放出CO2,所以硅酸的酸性比碳酸强
D.二氧化硅是酸性氧化物,它不溶于任何酸。
分析 二氧化硅不溶于水,不溶于强酸,但溶于氢氟酸。因为它能与碱反应生成盐和水,所以它是酸性氧化物。硅酸酸性比碳酸弱,它反映在CO2通入Na2SiO3溶液可生成硅酸。而SiO2能和Na2CO3高温下反应生成CO2,它可说明不挥发的SiO2可把气体CO2制出,但不能说明碳酸和硅酸的相对强弱。
答案:B
硅酸盐是由硅、氧、金属元素组成的化合物的总称,分布广,结构复杂化学性质稳定。一般不溶于水。(Na2SiO3 、K2SiO3除外)最典型的代表是硅酸钠Na2SiO3 :可溶,其水溶液称作水玻璃和泡花碱,可作肥皂填料、木材防火剂和黏胶剂。 常用硅酸盐产品:玻璃、陶瓷、水泥。
2. 硅单质与碳相似,有晶体和无定形两种。晶体硅结构类似于金刚石,有金属光泽的灰黑色固体,熔点高(1410℃),硬度大,较脆,常温下化学性质不活泼。是良好的半导体,应用:半导体晶体管及芯片、光电池。
硅单质与碳相似,有晶体和无定形两种。晶体硅结构类似于金刚石,有金属光泽的灰黑色固体,熔点高(1410℃),硬度大,较脆,常温下化学性质不活泼。是良好的半导体,应用:半导体晶体管及芯片、光电池。
16.(15分)如图所示,水平绝缘粗糙的轨道AB与处于竖直平面内的半圆形绝缘光滑轨道BC平滑连接,半圆形轨道的半径 .在轨道所在空间存在水平向右的匀强电场,电场线与轨道所在的平面平行,电场强度
.在轨道所在空间存在水平向右的匀强电场,电场线与轨道所在的平面平行,电场强度 .现有一电荷量
.现有一电荷量 ,质量
,质量 的带电体(可视为质点),在水平轨道上的P点由静止释放,带电体恰好能通过半圆形轨道的最高点C,然后落至水平轨道上的D点.取
的带电体(可视为质点),在水平轨道上的P点由静止释放,带电体恰好能通过半圆形轨道的最高点C,然后落至水平轨道上的D点.取 .试求:
.试求:
(1)带电体在圆形轨道C点的速度大小.
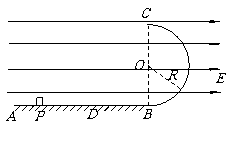 (2)D点到B点的距离
(2)D点到B点的距离 .
.
(3)带电体运动到圆形轨道B点时对圆形轨道的压力大小.
(4)带电体在从P开始运动到落至D点的过程中的最大动能.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com