

2.集合 ,则M的子集个数为 ( )
,则M的子集个数为 ( )
A. 2 B. 3 C. 4 D.8
1.复数 等于 ( )
等于 ( )
A. B.
B. C.
C. D.
D.
27.(15分)用下列仪器、药品验证由铜和适量硝酸反应产生的气体中含NO(仪器可选择使用,N2和O2的用量可自由控制)。
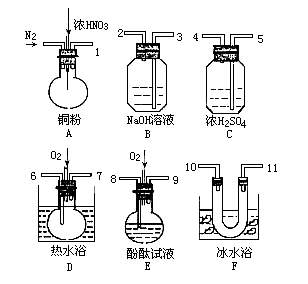
已知:①
② 气体液化温度:NO2 21℃, NO -152℃
试回答:
(1)写出装置A中发生反应的化学方程式_____ 。
(2)仪器的连接顺序(按左→右连接,填各接口的编号)为____。在填加药品前应先进行的操作是 。
(3)反应前先通入N2,目的是______ ;
(4)确认气体中含NO的现象是________ 。
(5)装置B、F的作用是 _______ 。
(6)若从A出来的混合气体中NO2、NO的体积分别为V1mL、V2mL,若最终氮的氧化物完全被溶液吸收,装置中至少需要充入氧气的体积为: (相同状态下)。
26.(10分)海水中可提取多种化工原料,下面是工业上对海水的几项综合利用示意图。

根据示意图回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,精制时所用试剂为盐 酸、BaCl2溶液、NaOH溶液、Na2CO3溶液,加入试剂的顺序是 、 、 、 。
(2)电解饱和食盐水的总反应的化学方程式为 。
(3)工业上MgCl2·6H2O晶体在 气氛中加热脱水,通入此种气体的作用是 。
25.(10分)(1)已知:在1×105Pa条件下,氢气的标准燃烧热是285.8 kJ·mol-1,下列热化学方程式正确的是 ( )
A.H2O(g)=H2(g)+1/2O2(g) ΔH=+285.8kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) ΔH=-517.6kJ·mol-1
C.H2(g)+1/2 O2(g)=H2O(g) ΔH=-285.8kJ·mol-1-
D.2H2(g)+O2(g)=2H2O(l) ΔH=+517.6J·mol-1
(2)科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的。”利用盖斯定律可测某些特别反应的热效应。
① P4(s,白磷)+ 5O2(g)=P4O10(s); ΔH=-2983.2kJ·mol-1
② P(s,红磷)+ 5/4 O2 (g) =1/4 P4O10(s) ΔH=-738.5kJ·mol-1-
则白磷转化为红磷的热化学方程式_________________________________。相同的状况下,能量较低的是_________;白磷的稳定性比红磷___________(填“高”或“低”)。
24.(11分)一瓶澄清透明的溶液,可能含有下列离子中的一种或几种:Fe2+、Fe3+、Ba2+、Al3+、NH4+、SO42-、 HCO3-、NO3-、Cl-取溶液进行如下实验:
①溶液滴在蓝色石蕊试纸上,试纸呈红色。
②取少量溶液浓缩后加入铜片和浓硫酸共热,有红棕色气体生成。
③取少量溶液,加入用硝酸酸化的氯化钡溶液,产生白色沉淀。
④另将③中的沉淀过滤出,滤液中加入硝酸银溶液,生成白色沉淀
⑤另取原溶液,逐滴加入氢氧化钠溶液至过量,先看到生成沉淀,随之该沉淀部分溶 解,并呈红褐色。
根据上述实验现象推断:
(1)溶液中肯定存在的离子有 。
(2)溶液中肯定不存在的离子有 。
(3)溶液中不能确定是否存在的离子有 。
(4)对上述实验操作做何改进,才能确定(3)中的离子是否存在 。
23.(8分)在试管里放入一块铜片,注入一定体积的浓硫酸,给试管加热,使之反应。
(1)若铜片还有剩余,硫酸__ __消耗完毕(填“已”或“没有”)。其理由是 。
(2)用一定量的废铜屑制取胆矾,有两种方法:第一种是取Cu与浓H2SO4直接反应;第二种是先将铜在空气中加热使之生成CuO,再与稀H2SO4反应,其中_ _种方法好,理由是____ ____。
22.在由Na2S、Na2SO3、Na2SO4组成的固体混合物中,已知S的质量分数为25.6% ,则氧的质量分数为: ( )
A.36.8% B.37.6% C.51.2% D.无法计算
21.某混合气体中可能含有H2、CO、CO2、HCl、NH3、和H2O(气)中的两种或多种,当混合气体依次通过:①澄清石灰水(无混浊现象);②氢氧化钡溶液(有混浊现象);③浓硫酸(无明显现象);④灼热的氧化铜(变红);⑤无水硫酸铜(变蓝)。对该混合气体成分的正确判断是 ( )
A.一定没有CO2,肯定有H2 B.一定有CO、CO2和H2O(气)
C.可能有CO2、NH3、和H2O(气) D.一定有H2、CO2、HCl、
20.世界著名的科技史专家、英国剑桥大学的李约瑟博士考证说:“中国至少在距今3000年以前,就已经使用玻璃了。”下列有关玻璃的说法不正确的是 ( )
A.制普通玻璃的原料主要是纯碱、石灰石和石英
B.玻璃在加热熔化时有固定的熔点
C.普通玻璃的成分主要是硅酸钠、硅酸钙和二氧化硅
D.盛放烧碱溶液的试剂瓶不能用玻璃塞,是为了防止烧碱跟二氧化硅生成硅酸钠而使瓶塞与瓶口粘在一起
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com