
16.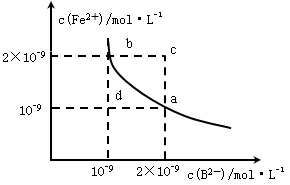 (7分)将0.2mol·L-1 HA溶液与0.2mol·L-1 NaOH溶液等体积混合,混合液中c(Na+)>c(A-),则(用“>”、“<”或“=”填写下列空白)。
(7分)将0.2mol·L-1 HA溶液与0.2mol·L-1 NaOH溶液等体积混合,混合液中c(Na+)>c(A-),则(用“>”、“<”或“=”填写下列空白)。
(1)混合溶液中c(HA)_______c(A-);(2)混合溶液中c(HA)+c(A-)______0.1mol/L;
(3)混合溶液中由水电离出的c(OH-)______0.2mol·L-1 HA溶液中由水电离出的c(H+);
(4)25℃时,如果取0.2mol·L-1 HA溶液与0.11mol·L-1 NaOH溶液等体积混合,混合液pH<7,则混合液中HA的电离程度______NaA的水解程度。
(5)某温度下,FeB(s)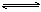 Fe2+(aq)+B2-(aq),FeB在水中
Fe2+(aq)+B2-(aq),FeB在水中 的沉淀溶解平衡曲线如下图所示。
的沉淀溶解平衡曲线如下图所示。
下列说法错误的是_____________
A.a点对应的KSP等于b点对应的KSP
B.d点无沉淀生成
C.可以通过升温实现由a点变到c点
D.此温度下,KSP=4×10-18
15.下列叙述正确的是
A.pH相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2]
< c[(NH4)2SO4] < c(NH4Cl)
B.因为AgI的溶解度小于AgCl的溶解度,所以向AgI悬浊液中滴入KCl溶液,不能生成AgCl沉淀
C.0.2mol/L HCl溶液与等体积0.05mol/L
Ba(OH)2溶液混合后,溶液的pH=1
D.0.2mol/L的NaHCO3溶液中c(H+)+c(H2CO3)=c(CO32-)+c(OH-)

第Ⅱ卷
本卷有5小题,共55分。
14.常温下,将V1mL
c1 mol/L的醋酸溶液滴加到V2
mL c2 mol/L的氢氧化钠溶液中,下列结论正确的是:
A.若V1=V2 ,且溶液的pH>7,则一定有c1<c2
B.若混合液的pH=7,则一定有c1v1>c2v2
C.若混合液的pH=7,则混合液中c(CH3COO-)>c(Na+)
D.若c1V1=c2V2,则混合溶液中有c(OH-)>c(CH3COOH)+c(H+)
13.一定温度下,在体积为VL的密闭容器中加入3molX进行如下反应:
3X(g)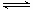 2Z(g)+W(s);△H>0达到平衡,下列判断正确的是:
2Z(g)+W(s);△H>0达到平衡,下列判断正确的是:
A.向平衡混合物中加入少量W,正、逆反应速率均增大
B.平衡后再加入1molX,上述反应的△H增大
C.温度不变,再加入2
molX,重新达到平衡时X的转化率大于原平衡
D.当容器中混合气体的密度不变时不能证明此反应已达到平衡状态
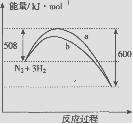
12.右图是298K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是
A.该反应的热化学方程式为:N2+3H2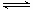 2NH3
△H=-92kJ/mol
2NH3
△H=-92kJ/mol
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热增大
D.在温度体积一定的条件下,通入1mol N2和3 mol H2反应后放出的 热量为Q1kJ,若通入2 mol N2和6mol H2反应后放出的热量为Q2kJ,则184>Q2>2Q1
11.有关热化学方程式的书写与对应表述均正确的是:
A.密闭容器中,1molSO2与0.5mol O2混合加热生成0.5mol SO3时,放出19.12
kJ热量。则O2(g)+2SO2(g)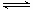 2SO3(g) ; △H= -76.48KJ
2SO3(g) ; △H= -76.48KJ
B.在101 kPa时,2g H2完全燃烧生成液态水,放出285.8
kJ热量,则电解水的热化学方程式表示为2H2O(l)=2H2(g)+O2(g);ΔH=571.6 kJ/mol
C.在稀溶液中:H+(aq)+OH-(aq)= H2O(l);ΔH=-57.3 kJ/mol。若将含0.5mol H2SO4的溶液与含1 mol
NaOH的溶液混合,放出的热量大于57.3
kJ
 D.已知2C(s)+O2(g)=2CO(g); △H= -221 kJ/mol,则可知C的燃烧热为110.5 kJ/mol
D.已知2C(s)+O2(g)=2CO(g); △H= -221 kJ/mol,则可知C的燃烧热为110.5 kJ/mol
10.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
Cd + 2NiOOH + 2H2O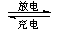 Cd(OH)2 + 2Ni(OH)2
Cd(OH)2 + 2Ni(OH)2
有关该电池的说法正确的是:
A.放电时负极附近溶液的碱性不变
B.充电过程中Cd被氧化
C.充电时阳极反应:Ni(OH)2-e-+OH-== NiOOH + H2O
D.放电时电解质溶液中的OH-向正极移动
9.下列离子方程式正确的是:
A.硫酸亚铁在空气中氧化:4Fe2++3O2+6H2O=4Fe(OH)3
B.向次氯酸钠溶液中通入少量SO2:4ClO-+SO2+H2O=
2Cl-+2HClO+SO42-
C.向Na2SO3、NaI的混合溶液中滴加少量氯水:2I-+C12==2Cl-+I2

D.1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积互相均匀混合:
2AlO2-+5H+ =Al(OH)3↓+Al3++H2O
8.下列各组离子在指定条件下一定能够大量共存的是:
A.含有较多Fe3+的溶液:Na+、SO42-、HS-、NH4+
B.由水电离出的c ( H十)=
l×l0-12 mol / L 的溶液中: K+、Na+、Cl一、SO32-
C.能使 pH 试纸变深蓝色的溶液中: S2一、AlO2-、S2O32-、Na +
D.遇Al能放出H2的溶液:NO3-、K+、Ca2+、Cl-
7.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:
3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M
则关于该反应的说法:①氧化剂是H3AsO3;②还原性:Cl->As;③每生成1molAs,反应中转移电子的物质的量为3mol;④M为OH-;⑤ SnCl62-是氧化产物。正确的是:
A.①③⑤
B.①②④⑤ C.①②③④ D.只有①③
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com