
3.同主族元素所形成的同一类型的化合物,其结构和性质往往相似,化合物PH4I是一种无色晶体,下列对它的描述中不正确的是 ( )
A. 它是一种共价化合物 B. 在加热时此化合物可以分解
C. 这种化合物不能跟碱发生反应 D. 该化合物可以由PH3跟HI化合而成
4在两种短周期元素组成的化合物中,它们的原子个数比为1:2,设两种元素的原子序数分别为a和b,则下列对a和b可能的关系概括得最完全的是 ( )
①a+b=15 ②a=b+15 ③a=b-5 ④a+b=22
A. ①④ B. ①③④ C. ①②③④ D. ①②④
5根据中学化学教材所附元素周期表判断,下列叙述不正确的是
A K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
B L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
C L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等
D M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等
6重水A与普通水B分别跟足量的金属钠反应,下列叙述正确的是 ( )
A. A、B的质量相等时,产生气体的体积在同温、同压下相等
B. A、B的质量相等时,产生气体的质量相等
C. A、B的物质的量相等时,产生气体的体积在同温、同压下相等
D. A、B的物质的量相等时,产生气体的质量相等
7短周期元素X、Y,X的原子序数小于Y的原子序数,二者可以形成两种气态化合物A和B。已知在相同条件下,A、B的密度之比为15:22,且当A、B以体积比1:3混合后,对H2的相对密度为20.25。试写出X、Y的元素符号及A、B的化学式。
8 A、B、C、D、E五种元素,它们的核电荷数按C、A、B、D、E顺序增大,C、D都能分别与A按原子个数比为1:1或1:2形成化合物,CB可与EA2反应生成C2A与气体物质EB4,E的M层电子数是K层电子数的2倍。请回答:
⑴写出这五种元素的名称:A________,B_________,C________,D________,E_______;
⑵画出E原子结构示意图:_________________________;
⑶写出D2A2和EB4的电子式:_____________,_____________;
⑷写出D单质与铜盐溶液反应的离子方程式:____________________________________。
9设想你去某外星球做了一次科学考察,采集了该星球上十种元素单质的样品,为了确定这些元素的相对位置以便系统地进行研究,你设计了一些实验并得到下列结果:
|
单质 |
A |
B |
C |
D |
E |
F |
G |
H |
I |
J |
|
熔点(℃) |
-150 |
550 |
160 |
210 |
-50 |
370 |
450 |
300 |
260 |
250 |
|
与水反应 |
|
√ |
|
|
|
√ |
√ |
√ |
|
|
|
与酸反应 |
|
√ |
|
√ |
|
√ |
√ |
√ |
|
√ |
|
与氧气反应 |
|
√ |
√ |
√ |
|
√ |
√ |
√ |
√ |
√ |
|
不发生化学反应 |
√ |
|
|
|
√ |
|
|
|
|
|
|
相对于A元素的 原子质量 |
1.0 |
8.0 |
15.6 |
17.1 |
23.8 |
31.8 |
20.0 |
29.6 |
3.9 |
18.0 |
按照元素性质的周期递变规律,试确定以上十种元素的相对位置,并填入下表:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
|
|
|
|
|
|
|
|
|
B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10 已知1个N2O3分子的质量为akg,1个N2O5分子的质量为bkg,若以1个氧原子(16O)质量的1/16作为相对原子质量的标准,则NO2的式量为_______________。
11下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。

(1)下列 (填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、1 ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
3.以第3周期为例,掌握同一周期内元素性质(如:原子半径、化合价、单质及化合物性质)的递变规律与原子结构的关系;以ⅠA族和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
[经典题型]
题型一:几个量的关系(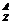 X)
X)
例1 已知某元素的阳离子R2+的核内中子数为n,质量数为A,则mg它的氧化物中所含质子的物质的量是 ( A )
A. 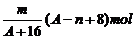 B.
B.
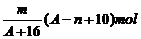
C. (A-n+2)mol
D. 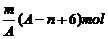
点拨: 由A→M→n→N
规律总结:
质量数(A)=质子数(Z)+中子数(N)
质子数=核电荷数=原子序数=原子的核外电子数
离子电荷数=质子数-核外电子数
巩固:1 以NA表示阿佛加德罗常数,下列说法中正确的是 ( B )
A 53g碳酸钠中含NA个CO32- B 0.1molOH-含NA个电子
C 1.8g重水(D2O)中含NA个中子
D 标准状况下11.2L臭氧中含NA个氧原子
题型二:0族元素的原子序数和电子排布及电子排布的规律运用
例2 写出10电子的微粒的化学式
指出53号元素在周期表中的位置
点拨:10电子的稳定结构→Ne→以Ne为中心→左右移动
54号元素是第5号0族元素→回答的是53号→前推一位
规律总结:
0族元素的原子序数和电子排布的规律很强:2、10、18、36、54、86、118相隔二个8、二个18、二个32;8、18、32就是该周期容纳的元素种类。阴、阳离子的稳定结构就是向最近的0族靠。
例3 R为短周期元素,其原子所具有的电子层数为最外层电子数的1/2。它可能形成的含氧酸根离子有①R2O42-、②RO4-、③R2O32-、④RO3-。下列判断正确的是 ( BC )
A. 当它形成①时,不可能形成④ B. 当它形成②时,不可能形成③、④
C. 当它形成①时,不可能形成②、③ D. 当它形成②时,可以形成①
点拨:易漏解应全面思考
规律总结:
⑴核外电子是由里向外,分层排布的。
⑵各电子层最多容纳的电子数为2n2个;最外层电子数不得超过8个,次外层电子数不得超过18个,倒数第三层电子数不得超过32个。
⑶以上几点互相联系。
核外电子排布规律是书写结构示意图的主要依据。
巩固:2 具有下列结构的原子一定属于碱金属的是 ( CD )
A. 最外层只有1个电子 B. 最外层电子数为次外层电子数的一半
C. M层电子数为K层电子数的一半 D. K、L层电子数之和比M、N层电子数之和大1
3 分别处于第二、三周期的主族元素A和B,它们的离子的电子层相差2层。已知A处于第m族;B处于第n族;A只有正化合价。则A、B原子核外电子总数分别为 ( D )
A. m、n B. 3、7 C. m-2、10n D. m+2、n+10
题型三:推断元素原子序数差
例4 若短周期中的两种元素可以形成原子个数比为2:3的化合物,则这两种元素的原子序数之差不可能是 (D)
A. 1 B. 2 C. 5 D. 6
点拨:设两种元素的符号分别为X和Y,则化合物的化学式为X2Y3,即X为+3价,Y为-2价,在短周期元素中满足此要求的X元素有5B、7N、13Al,Y元素有8O和16S。
规律总结:
从化合价入手或从直觉----代表物入手都可以。
巩固:4 周期表前20号元素中,某两种元素的原子序数相差3,周期数相差1,它们形成化合物时原子个数之比为1︰2。写出这些化合物的化学式 。
题型四:位、构、性三者关系
例5 下表是X、Y、Z三种元素的氢化物的某些性质: ( B )
|
元素 |
熔点/℃ |
沸点/℃ |
与水的反应 |
导电性(纯液体) |
|
X |
-283 |
-162 |
不反应 |
不导电 |
|
Y |
-102 |
19 |
放热反应,形成酸性溶液 |
不导电 |
|
Z |
680 |
/ |
剧烈反应,生成H2,并形成碱性溶液 |
导电 |
若X、Y、Z这三种元素属于周期表中的同一周期,则它们的原子序数递增的顺序是
A. X、Y、Z B. Z、X、Y C. Y、X、Z D. Z、Y、X
点拨:导电性→化合物类型;与水反应→氢化物的稳定性
例6 砹(At)是原子序数最大的卤族元素,推测砹或砹的化合物不可能具有的性质是(A)
A. HAt很稳定 B. 易溶于某些有机溶剂
C. AgAt不溶于水 D. 是有色固体
点拨:位近性近
例7 在一定条件下,RO3n-中和氟气可发生如下反应:
RO3n- + F2 +2OH-=RO4- +2F-- +H2O 已知R为短周期元素,则可知在RO3n--中,元素R的化合价是 ;元素R在周期表中的位置是 。
点拨:离子方程式的电荷守恒和氟无正价
规律总结:结构决定位置,结构决定性质,位置体现性质。
周期数=电子层数
主族数=最外层电子数=最高正价数
|最高正价|+|负价|=8
巩固:5 X、Y、Z是短周期元素的三种常见氧化物。X跟水反应后可生成一种具有还原性的不稳定的二元酸,该酸的化学式是 ;Y和X的组成元素相同,Y的化学式是 ;1mol Z在加热时跟水反应的产物需要用6mol的氢氧化钠才能完全中和,在一定条件下,Y可以跟非金属单质A反应生成X和Z,单质A是 。
6 同周期的X、Y、Z三种元素,已知它们的最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是 ( )
A. 含氧酸的酸性:H3ZO4>H2YO4>H3XO4 B. 非金属性:X>Y>Z
C. 气态氢化物的稳定性按X、Y、Z顺序由弱到强
D. 元素的负化合价的绝对值按X、Y、Z顺序由小到大
7 周期表中相邻的A、B、C三元素中,A、B同周期,A、C同主族。已知三种元素的原子最外层电子数之和为19,三种元素的原子核中质子数之和为41。则这三种元素是A___S__、B__Cl___、C___O___(填元素符号)。
随堂作业:
1 设某元素某原子核内的质子数为m,中子数为n,则下述论断中正确的是
A. 不能由此确定该元素的相对原子质量
B. 这种原子的相对原子质量为m+n
C. 若碳原子质量为wg,此原子的质量为(m+n)wg
D. 核内中子的总质量小于质子的质量
2 X和Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素的阳离子半径,Z和Y两元素的原子核外电子层数相同,Z元素的原子半径小于Y元素的原子半径。X、Y、Z三种元素原子序数的关系是 (D)
A. X>Y>Z B. Y>X>Z C. Z>X>Y D. Z>Y>X
2.掌握元素周期表(长式)中0族元素的原子序数和电子排布。
1.掌握原子序数、核电荷数、质子数、中子数、核外电子数、质量数之间的相互关系。
30.除南极洲外,其他各大洲共有的自然带是
A.亚热带常绿硬叶林带 B.温带落叶阔叶林
C.热带荒漠带 D.热带雨林带
 图10为北半球某地某日太阳高度变化图。读图回答28-29题。
图10为北半球某地某日太阳高度变化图。读图回答28-29题。
28.下列叙述正确的是
A.此日该地昼长为16小时
B.该日过后,太阳直射点将向北移动
C.该地地方时与北京时间相差10小时
D.北京时间12点时该地太阳高度达最大值
29.该地的时区是
A.东二区 B.西二区
C.东四区 D.西四区
27. 图9是l3世纪和现代亚热带北界分布示意
图9是l3世纪和现代亚热带北界分布示意
图,从中可推测
A.l3世纪比现代暖
B.l3世纪比现代冷
C.l3世纪的南京位于温带地区
D.13世纪的郑州位于亚热带地区
读兰州市略图(图8),分析回答25-26题。
|

A.第一级阶梯
B.第二级阶梯
C.第三级阶梯
D.一、二阶梯过渡地带
26.兰州是一座沿黄河河谷而建的城市,
整个城市呈东西向带状分布,最主
要的影响因素是
A.矿产资源的分布状况 B.政治经济的发展
C.交通运输的需要 D.地形和河流的分布
24.水资源短缺对浙江省经济发展的影响是
(A)促进城乡一体化 (B)增加水稻播种面积
(C)促使产业结构调整 (D)加快南水北调进程
水资源短缺已成为浙江省可持续发展的制约因素。读图(图7)回答22-23题。
23.浙江省人均水资源低于全国平均水平,并接近国际公认警戒线的原因是
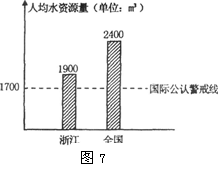 ①人口密度大 ②水资源污染严重
①人口密度大 ②水资源污染严重
③降水总量少 ④降水季节分配均匀
(A)①② (B)②③ (C)②④ (D)③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com