
3.金刚烷的结构如右图,它可看作是由四个等同的六元环组成的空间构型。请根据中学学过的异构现象判断由氯原子取代金刚烷亚甲基(一CH2一)中氢原子所形成的二氯取代物的种类 ( )
A.2种 B.3种 C.4种 D.6种
2.下列涉及有机物的性质或应用的说法,不正确的是 ( )
 A.苯、乙醇和乙酸都能发生取代反应
A.苯、乙醇和乙酸都能发生取代反应
B.用新制的Cu(OH)2可检验尿液中的葡萄糖
C.甲烷和氯气的混合气体在光照下反应生成的是一氯甲烷和氯化氢
D.油脂在碱的催化作用下可发生水解,工业上利用该反应生产肥皂
1.下列有关比较中,大小顺序排列不正确的是 ( )
A.物质的熔点:石英>食盐>冰
B.热稳定性:PH3>H2 S>HBr>NH3
C.结合H’的能力:CO >CH3COO >SO
>CH3COO >SO
D.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
 石油的裂解已成为生产乙烯的主要方法
石油的裂解已成为生产乙烯的主要方法
 乙烯分子式:C2H4 结构简式:CH2==CH2 结构式
乙烯分子式:C2H4 结构简式:CH2==CH2 结构式
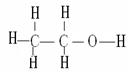
乙醇分子式:C2H6O 官能团-OH 结构简式:CH3CH2OH 结构式
乙酸分子式:C2H4O2,结构式:结构简式CH3COOH
 加成反应:CH2=CH2+H2O
加成反应:CH2=CH2+H2O CH3CH2OH CH2=CH2+Br2→CH2BrCH2Br
CH3CH2OH CH2=CH2+Br2→CH2BrCH2Br
加聚反应
2CH3CH2OH
+ O2  2CH3CHO + 2H2O
2CH3CHO + 2H2O
CH3CH2OH
+ CH3COOH 
 CH3COOCH2CH3 + H2O
CH3COOCH2CH3 + H2O
淀粉水解生成葡萄糖 检验葡萄糖(1)银镜反应 (2)与新制Cu(OH)2反应砖红色沉淀
油脂水解生成高级脂肪酸和甘油 蛋白质水解生成氨基酸
蛋白质 Na2SO4 、(NH4)2SO4 盐析 蛋白质 强酸 强碱 加热 重金属盐 乙醇 福尔马林 变性
化学反应速率: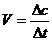
影响化学反应速率的因素:(
温度:温度越高反应速率越快)
压强:对于有气体参加的反应,增加压强化学反应速率越快
浓度:浓度越大反应速率越快
催化剂:使用正催化剂化学反应速率增大
放热反应:反应物的总能量>生成物的总能量 吸热反应:生成物的总能量>反应物的总能量
锌--铜原电池
负极: Zn-2e==Zn2+ 氧化反应 电子:负极→正极 电流:正极→负极
正极: 2H++2e=H2↑ 还原反应 (有气泡)
总反应:Zn+2H+==Zn2++H2↑ 溶液质量增加 PH增大


 物质的电子式:N2 CO2
H2O
物质的电子式:N2 CO2
H2O

NaCl MgCl2
 NaOH Na+
NaOH Na+
物质的形成过程:
(1)H Cl : 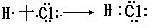 (2)NaCl:
(2)NaCl:
同周期,从左到右 元素的金属性逐渐减弱,元素的非金属性逐渐增强 原子半径减小
同主族,从上到下 元素的金属性逐渐增强,元素的非金属性逐渐减弱 原子半径增大
Na Mg Al Si P S Cl 金属性:Na>Mg>Al
金属性逐渐减弱 非金属性逐渐增强 非金属性:Cl>S>P>Si,
①元素的金属性越强,最高价氧化物对应的水化物(氢氧化物)碱性越 强,反之也如此。金属性:Na>Mg>Al,氢氧化物碱性强弱为NaOH > Mg(OH)2> Al(OH)3。
②元素的非金属性越强,最高价氧化物对应的水化物(含氧酸)酸性越 强 ,反之也如此。
非金属性:Si <P< S< Cl,H3PO4是 弱 酸,H2SO4是 强 酸, HClO4是最强酸;H3PO4 <H2SO4<HClO4 元素的非金属性越强,形成的氢化物越 稳定;氢化物的稳定性为SiH4<PH3<H2S<HCl
电解食盐水: 2NaCl + 2H2O == 2NaOH + H2↑ +Cl2↑ 铁与Cl2反应:2Fe+3Cl2===2FeCl3
Cl2 与 水:Cl2+H2O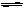 HCl+HClO Cl2与NaOH:Cl2 +2NaOH=== NaCl+NaClO +H2O
HCl+HClO Cl2与NaOH:Cl2 +2NaOH=== NaCl+NaClO +H2O
碘的提取: 2KI + C12 ==2KCl + I2 钠与水反应:2Na+2H2O=2NaOH+H2↑
碳酸钠与碳酸氢钠的性质比较
|
溶解性 |
易溶(同温下,溶解度大于碳酸氢钠) |
易溶 |
|
热稳定性 |
稳定( |
2NaHCO3△Na2CO3+CO2↑+H2O
|
|
碱性 |
碱性(相同浓度时,碳酸钠水溶液的PH比碳酸氢钠的大) |
碱性 |
|
盐酸 |
生成CO2 |
生成CO2 比碳酸钠与盐酸反应剧烈( |
碳酸钠与碳酸氢钠鉴别
固体:加热产生气体的是NaHCO3 溶液:加BaCl2产生沉淀的是Na2CO3
Al与强碱反应 2Al + 2 NaOH + 2H2O===2NaAlO2+3H2↑(唯一的一个)
氧化铝(Al2O3):溶于强碱Al2O3 + 2 NaOH = 2NaAlO2 + H2O
离子方程式 Al2O3 + 2OH-= 2AlO2-+ H2O 氢氧化铝和强碱反应 Al(OH)3 + NaOH = NaAlO2 + 2H2O
Fe3+检验:溶液中加入KSCN Fe3++3SCN一══Fe(SCN)3
Cl2与FeCl2反应:2FeCl2+Cl2==2FeCl3
FeCl3 与铁反应 : 2FeCl3 +Fe==3FeCl2
FeCl3 与铜反应:Cu+2FeCl3==CuCl2+2FeCl2
钢铁:电化学腐蚀,碳铁形成原电池
金属防腐的方法1.表面覆盖保护层, 2.改变内部结构; 3. 电化学保护法
SiO2与碱反应:SiO2+2NaOH==Na2SiO3+H2O 实验室装NaOH的试剂瓶用橡皮塞不用玻璃塞
二氧化硅的用途:SiO2是制造光导纤维的主要原料
硅酸盐工业:水泥的原料是黏土和石灰石 玻璃的原料是纯碱、石灰石和石英, (都有石灰石)
|
|
C与浓 H2SO4反应:C+2H2SO4(浓)====CO2↑+2SO2↑+2H2O
铵盐的性质:①易溶于水②与碱反应放出氨气③受热易分解④与碱反应放出氨气
HNO3强氧化性: Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO + 4H2O
C + 4HNO3(浓) = CO2 + 4NO2 + 2H2O
钝化作用:常温下, 浓HNO3使Fe、Al钝化。
 质子 Z
质子 Z
 原子核
原子核
原子ZAX 中子
电子
质量关系:质量数(A)=质子数(Z)+中子数(N)
电性关系:原子:核电荷数=质子数=核外电子数
同位素:质子数相同而中子数不同原子的互称 H: H
H  H(D)
H(D)
 H(T)
;35 Cl 37Cl
H(T)
;35 Cl 37Cl
同素异形体:O2 O3 ; 红磷、 白磷 ; 金刚石 石墨 C60
同分异构体:分子式相同结构式不同 CH3CH2OH CH3OCH3 ; 正丁烷 异丁烷
|
物质的分离 |
||
|
过滤 |
固体与液体不互溶的混合物 |
粗盐的提纯 |
|
结晶与重结晶 |
混合物中各成分在溶剂中溶解度不同,包括蒸发溶剂结晶和降温结晶 |
提纯混有KCl的KNO3 (降温结晶) |
|
分液 |
两种互不混溶的液体混合物 |
CCl4和水的分离(分液漏斗) |
|
萃取 |
溶质在互不相溶的溶剂里溶解度不同 |
利用CCl4从溴水(碘水)中萃取溴 |
|
蒸馏(分馏) |
①
互溶液体沸点有明显差异 (蒸馏烧瓶、冷凝管、温度计) |
蒸馏水、石油的分馏 CCl4和甲苯混合物的分离 |
|
|
||
|
离子的鉴别 |
||
|
离子 |
方法及现象 |
|
|
CO32- |
与含Ba2+的溶液反应,生成白色沉淀,该沉淀溶于硝酸(或盐酸),生成无色无气味、能使澄清石灰水变浑浊的气体(CO2)。 |
|
|
SO42- |
先加稀盐酸,再加BaCl2溶液反应,生成白色沉淀。 |
|
|
Cl- |
与硝酸银溶液反应,生成不溶于稀硝酸的白色沉淀。 |
|
|
NH4+ |
与NaOH浓溶液反应,微热,放出使湿润的红色石蕊试纸变蓝的刺激性气味气体(NH3)。 |
|
|
Fe3+ |
KSCN 溶液变红色 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com