
1. 酸碱离解平衡的概念及应用离解算式进行简单计算的能力。
2.
(5分) 由于水杨酸的pKa2 =13.1,而酚酞终点pH=9.0,可见终点时产物为
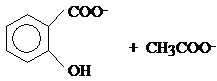 ,因此在测定中,每一摩尔的乙酰水杨酸消耗2摩尔的NaOH。 (2分)
,因此在测定中,每一摩尔的乙酰水杨酸消耗2摩尔的NaOH。 (2分)
含量(g/片)= (3分)
(3分)
注:考核点
1. (5分)
根据离解平衡:HA H++A- ,
H++A- ,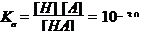
\在胃中  (2分)
(2分)
即 
而在血浆中,\HA的离解增大
\
即 (2分)
(2分)
则总药物之比:
 或2.5´104 (1分)
或2.5´104 (1分)
3. 共6分,每小题2分
①缓冲剂,控制酸度,抑制放H2,水解,沉淀等。 (2分)
②配合剂,降低[Cu2+](即电位下降),阻止与新生态Cu反应。 (2分)
③抗氧剂,抑制氧化反应。 (2分)
④稳定剂,防止累积的Fe2+对铜的沉积产生不良影响和减缓Fe2+氧化为Fe3+。 (2分)
第三题
(1)(4分)
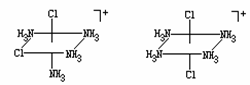
A: [Co(CO3)(NH3)4]Cl;(0.5分) C中配离子的立体结构 D中配离子的立体结构
B: C和D的混合物;(0.5分) (1分) (1分)
C: cis-[CoCl2(NH3)4]Cl·0.5H2O; (0.5分)
D: trans-[CoCl2(NH3)4]Cl·HCl·H2O;(0.5分 )
(2) (3分)
8NH4+ +  O2 + 2CoCO3 = 2[Co(CO3)(NH3)4]+
+ 6H+ + H2O
(1分)
O2 + 2CoCO3 = 2[Co(CO3)(NH3)4]+
+ 6H+ + H2O
(1分)
[Co(CO3)(NH3)4]Cl
+ 2HCl  cis-[CoCl2(NH3)4]Cl·0.5H2O(主产物) +CO2 +
cis-[CoCl2(NH3)4]Cl·0.5H2O(主产物) +CO2 +  H2O (1分)
H2O (1分)
cis-[CoCl2(NH3)4]Cl·0.5H2O + HCl + H2O
H2O
trans-[CoCl2(NH3)4]Cl·HCl·H2O (1分 )
(3) (2分)
由C与D中配离子的立体结构可知,由于前者中各个M-L键的极性不能相互抵消,C中相应的配离子具有极性(1分);而在后者中各个M-L键的极性可相互抵消,D中相应的配离子没有极性(1分)
(4) (1分)
用少量冷水洗涤B是为了除去D (0.5分)
浓盐酸起沉淀剂的作用 (0.5分)
(5) (1分)
C与D之间的转化属于顺-反异构化反应 (1分)
(6) (1分)
答案一:[CoCl2(en)2]+可被拆分的几何异构体形式应为顺式异构体(1分),经类比推测未知紫色化合物C为顺式构型。
或答案二:由题给条件推测紫色化合物在一定温度和浓盐酸条件下容易转化为绿色化合物D(1分) 第(6)题只要写出一种答案即给分。
第四题
2. 共8分
①Cu2++Cu+2H2O==2CuOH↓+2H+ (2分)
②CuOH+H++e==Cu+H2O j-=0.287V (2分)
Cu2++H2O+e==CuOH+H+ j+=0.314V (2分)
E = 0.027V > 0 正方向自发 (2分)
或  (6分)
(6分)
1. 共8分(每个方程式1分,杂质1分)
①CuO或Cu(OH)2 Cu2++2H2O == Cu(OH)2↓+2H+
②Cu2O或CuOH Cu++H2O == CuOH↓+H+
③FeO或Fe(OH)2 Fe2++2 H2O == Fe(OH)2↓+2H+
④Fe2O3或Fe(OH)3 2Fe(OH)2+ O2+H2O == 2Fe(OH)3↓
O2+H2O == 2Fe(OH)3↓
·写出Cu2+与Fe得到Cu+等等反应者,只要正确,不扣分。
·方程式未配平或配平错误均不得分。
5. ①降解中消耗水中的O2,使水质变坏;它易形成泡沫覆盖于水面,使水中的溶解氧减少;危及水生生物及鱼类的生存等。 (2分)
②最终产物为CO2+Na2SO4 (2分)
第二题(评判分22分,成绩分8分)
4. ①带电胶粒被DBS包覆后带上了憎水基。 (2分)
②通过相转移,消除了无机离子的干扰。 (2分)
3. Cr2O3·xH2O/ Cr3+/ (其他正确表达也给分) (2分)
(其他正确表达也给分) (2分)
2. ①Cr2O3·xH2O胶粒带正电荷,产生静电排斥。 (2分)
②胶粒带电形成的水化膜,可阻止粒子在碰撞中聚结变大。(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com