
3.t℃时,将一定量A(不含结晶水)的不饱和溶液均分为三份,分别加热蒸发,然后冷却为t℃,已知三份溶液分别蒸发水10g,20g,30g,析出A晶体的质量依次为ag,bg,cg.则a,b,c三者的关系是( )
A.c=a+b B.c=2b-a C.c=2b+a D.c=2a-b
2.类推的思维方法在化学学习和研究中常会产生错误的结论,因此类推出的结论最终要经过实践的检验才能决定其正确与否。下列几种类推结论中正确的是 ( )
A.第二周期元素氢化物稳定性顺序是HF>H2O>NH3;则第三周期元素氢化物稳定性顺序也是HCl>H2S>PH3
B.Fe3O4可写成FeO·Fe2O3;Pb3O4也可写成PbO·pb2O3
C.可电解熔融MgCl2来制取金属镁;也能电解熔融AlCl3来制取金属铝
D.晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子
1.2008年夏季奥运会将在北京举行,届时要突出“绿色奥运、人文奥运、科技奥运”理念。绿色奥运是指( )
A.加大反恐力度,并讲求各国运动员的营养搭配,使他们全身心投入比赛。
B.严禁使用兴奋剂,使运动员公平竞争。
C.把环境保护作为奥运设施规划和建设的首要条件
D.奥运场馆建设均使用天然材料,不使用合成材料
8.抗痉挛药物E的合成如下:

8-1.写出A、B.C、D、E的结构式。
8-2.在字母E前加上构型符号表示化合物E所有的立体异构体,并在对映体之间加一竖线表示它们的对映关系。
8-3.画出E的任意一个构型式,并用符号标出所有手性碳的构型。
2002年全国高中学生化学竞赛(决赛)理论试题
4-7.将化学计量的 NiO和 LiOH在空气中加热到 700℃可得LiNiO2,试写出反应方程式。
小8.写出LiNiO2正极的充电反应方程式。
49. 锂离子完全脱嵌时LiNiO2的层状结构会变得不稳定,用铝取代部分镍形成LiNi1-yAlyO2可防止锂离子完全脱嵌而起到稳定结构的作用,为什么?

图一
第5题
5-1.今有两种燃料,甲烷和氢气,设它们与氧气的反应为理想燃烧,利用下列298K的数据(设它们与温度无关)分别计算按化学计量比发生的燃烧反应所能达到的最高温度。

火箭所能达到的最大速度与喷气速度及火箭结构有关,由此可得到如下计算火箭推动力Isp的公式:
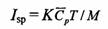
式中T和 Cp 分别为热力学温度和平均等压摩尔热容,K为与火箭结构有关的特性常数。
5-2.请问:式中的M是一个什么物理量?为什么?用上述两种燃料作为火箭燃料,以氧气为火箭氧化剂,按化学计量比发生燃烧反应,推动火箭前进,分别计算M值。
5-3.设火箭特性常数K与燃料无关,通过计算说明,上述哪种燃料用作火箭燃料的性能较好?
第6题
2002年伊始第一台磁冰箱问世。磁冰箱的概念形成干6年前,美国、中国、西班牙、荷兰和加拿大都进行了研究,最低制冷温度已达-140oC,能量利用率已比传统冰箱高l/3。1997年,美国Ames实验室设计出磁冰箱原型,其制冷装置可简单地用下图表示:
 一转轮满载顺磁性物质,高速旋转,其一侧有一强大磁场,顺磁性物质转入磁场为状态A,转出磁场为状态B,即:
一转轮满载顺磁性物质,高速旋转,其一侧有一强大磁场,顺磁性物质转入磁场为状态A,转出磁场为状态B,即:

回答下列问题:
6-1.用热力学基本状态函数的变化定性地解释:磁制冷物质发生A B的状态变化为什么会引起冰箱制冷?不要忘记指出磁场是在冰箱内还是在冰箱外。
B的状态变化为什么会引起冰箱制冷?不要忘记指出磁场是在冰箱内还是在冰箱外。
6-2.Ames实验室的磁致冷物质最早为某金属M,后改为其合金,以M5(SixGe1-x)4为通式,最近又研究了以MA2为通式的合金,A为铝、钴或镍。根据原子结构理论,最优选的M应为元素周期系第几号元素?为什么?(可不写出该元素的中文名称和元素符号)
第7题
阶式聚合是分子自组装的方式之一;其基本过程是:把阶式构件逐级连接到核心构件上,获得具有一定结构、单一分子量的高分子。核心构件可以是单官能团或多官能团(必须完全等价)的小分子;阶式构件是具备以下特点的小分子:含有一个(只有一个)可与核心构件缩合的官能团,同时含有一个或多个完全等价的可以转化成跟核心构件相同官能团的基团。如:一元醇ROH可以用作制备核心构件,3-氨基丙睛H2NCH2CH2CN可以作为阶式构件。核心构件的制备及阶式聚合反应示意如下:
(l) ROH + CH2=CHCN → ROCH2CH2CN →
ROCH2CH2COOH → ROCH2CH2COCl
(2) ROCH2CH2COCl + H2NCH2CH2CN →
ROCH2CH2CONHCH2CH2CN
以下步骤同(l)中的第2、3步。
(3)经过n次重复得到
ROCH2CH2CO(NHCH2CH2CO)n NHCH2CH2CN
(4)最后通过水解、酯化封端,得到性质稳定的高分子阶式聚合物。
为了使阶式聚合物的分子量尽快增加,可以选用多向核心构件和多向阶式构件,
如:双向核心构件:(CH2OCHCH2COCl)2
双向阶式构件: HNCH2CH2OCH2CHCN)2
7-1.写出上述双向核心构件与单向阶式构件的一次、两次和n次缩合得到的阶式聚合物的结构式(不要忘记封端!)。
7-2.选择适当原料制备双向阶式构件 HNCH2CH2OCH2CH2CN)2。
7-3.写出上述双向核心构件和双向阶式构件一次和两次缩合得到的阶式聚合物的结构式(不要忘记封端!)。
7-4.说明这种阶式聚合的名称中“阶式”二字的意义。
7-5.为什么多向阶式聚合需要的核心构件和阶式构件要求相关的官能团“完全等价”?甘油能否用作制备阶式聚合所需的多向核心构件?β-氨基葡萄糖能否用作制备阶式聚合所需的多向阶式构件?

7-6.多向阶式聚合时,分子量增长速度很快。目前已经实现了四向核心构件和三向阶式构件之间的阶式聚合,并得到了分子量高达60604的高分子。请你写出制备这个四向核心构件所需要的起始原料和三向阶式构件的结构式,并选择简单的原料(C1、C2和C3的任何有机化合物)分别制备它们。
Li1-xC6 + xLi+ + xe- →Li C6
其结果是,Li+嵌入石墨的A、B层间,导致石墨的层堆积方式发生改变,形成化学式为LiC6的嵌入化合物。
4-4.图二给出了一个Li+沿C轴投影在A层上的位置,试在图上标出与该离子临近的其它六个 Li十的投影位置。
4-5.在 Li C6中,Li+与相邻石墨六元环的作用力属何种键型?
4-6.某石墨嵌入化合物每个六元环都对应一个Li+,写出它的化学式,画出它的晶胞(C轴向上)。
4-1.试确定该晶胞的碳原子个数。
4-2.写出晶胞内各碳的原子坐标。
4-3.已知石墨的层间距为 334.8 pm,C-C键长为 142 pm,计算石墨晶体的密度。
 ;
; ;
;  ;
;
A B C
 ;
;  ;
; ;
;
D E G H
评分标准:
1. 每个结构式或结构简式2分,共14分,有错不给分。
* 注:C和D在LiAlH4作用下可分别生成E和G,但也有可能分别生成单环萜烷醇。本题只要求写出E和D, 若选手应答时写出在写出E和D的同时写出单环萜烷醇,不扣分。
第七题:
(1)将8´式(2)+9´式(3)-式(1)得
8C(石墨)+9H2(g)→C8H18(g)
DrHmy= 8D2Hmy+9D3Hmy-D1Hmy = –207.8 kJ·mol–1
DrSmy= SnBSmy (B) = –757.252J·K-1·mol–1
DrGmy = DrHmy - T´DrSmy = 17.861kJ·mol–1
Kpy = exp(–DrGmy/RT) = 7.36´10–4
(2)∵ Kx=Kpy (p/py)–Dn,Dn= –8
当压力不高时,Kpy为常数,Kx随总压的增加而增大,故有利于正辛烷的生成。
(3) DrHmy<0,Kpy随温度升高而减小,
∴ 升高温度不利于正辛烷的生成。
(4)若x(C8H18)=0.1,
则Qp=[p(C8H18)/py] / [p(H2)/py]9=0.258>>Kpy=7.36´10-4
故x(C8H18)不能达到0.1
(5)若使x(C8H18)=0.5,
Kpy=Kx(p/py)-8=7.36´10-4
求得p=499 kPa
以上每小题各2分
第八题
(1) 根据上述实验事实,设反应的实验速率方程为 ,
,
由于在缓冲溶液中反应,[H+] 为常数,故可简化上式为:
 ,
,
令a=1,可得 , (3分)
, (3分)
又[A]0µP¥ ,[A]µP¥-P,且温度一定, 比例系数一定,可得
比例系数一定,可得

与实验事实相符,可见,a=1是对的;
又据准一级反应,可得
取对数,
 (3分)
(3分)
已知 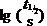 -pH直线斜率=-1,故b = –1,则有
-pH直线斜率=-1,故b = –1,则有

与实验事实相符,由此可得该反应实验速率方程为
 (1分)
(1分)
(2) 由上述反应机理知:
 (1)
(1)
应用稳态近似,
\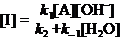 (2)
(2)
将(2)式代入(1)式得:
 (3)
(3)
当 >>
>> 时,则
时,则

又  (4)
(4)
将(4)式代入(3)式,经整理得:

 ,
,  (3分)
(3分)
可见与实验事实相符。
3. 能从普通的百分含量算式转化为药片含量(g/片)的计算
第五题:
 (2分)
(2分) (2分)
(2分)
 (2分)
(2分)  (2分)
(2分)
 (2分)
(2分)
注:
(1) A→D的结构写成平面结构,只要对,都给2分。
(2) 结构式中, 碳架标氢时, 氢的数目不对, 每处扣0.5分;都不标氢不扣分。
2. 在一定条件(pH)下,两反应物之间的化学计量关系(1:2)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com