
1.废电池的污染引起人们的广泛重视,废电池中对环境形成污染的主要物质是( )
A.锌 B.汞 C.石墨 D.二氧化锰
3、 燃料电池
燃料电池是一种持续地将燃料和氧化剂的化学能直接转换成电能的化学电池。它与一般的化学电源不同,一般化学电池的活性物质储存在电池内部,故而限制了电池的容量,而燃料电池的电极本身不包括活性物质,只是一个催化转化元件。
如:氢氧燃料电池。
①酸性介质时,电极反应:
负极:
正极:
总反应:
②碱性介质时,电极反应:
负极:
正极:
总反应:
除H2外,烃、肼、甲醇、氨、煤气等液体或气体,均可作燃料电池的燃料;除纯氧气外,空气中的氧气也可作氧化剂。
练习、新型燃料电池,甲烷、氧气及KOH电解质溶液,用Pt作两个电极,写出两个电极的电极反应式和总反应式。
[巩固练习]
2、 二次电池(又称充电电池或蓄电池)
|
|
 2PbSO4(s)
+2H2O(l)
2PbSO4(s)
+2H2O(l)
①其放电电极反应:
负极( ):
正极( ):
②其充电反应是上述反应的逆过程,则电极反应:
(电化学上规定:发生氧化反应的电极为阳极,发生还原反应的电极为阴极)
阴极:
阳极:
1、 一次电池(又称干电池)
如:普通锌锰电池、碱性锌锰电池、锌银电池、锂电池等。
(1)碱性锌锰电池,电解质是KOH,其电极反应:
负极(Zn):
正极(MnO2):
总反应:
(2)锌银电池的负极是Zn,正极是Ag2O,电解质是KOH,其电极总反应如下:
Zn + Ag2O = ZnO + 2Ag
则:负极( ):
正极( ):
5、电极反应方程式的书写
注意:(1)需标出正负极及电极材料;
(2)遵循三大守恒(电子得失守恒、质量守恒、电荷守恒)
如:Fe-Cu( 稀硫酸)
负极(Fe):Fe – 2e = Fe2+
正极(Cu):2H+ +2e = H2↑
总反应:Fe + 2H+ = Fe2+ + H2↑
练习3:请写出下列原电池电极反应式及总反应式。
Fe-C ( 稀硫酸)
Cu -Ag (硝酸银溶液)
Al - Mg (氢氧化钠溶液)
Fe-Cu( 稀硝酸)
练习4:请把 Fe + 2FeCl3 = 3FeCl2,设计成原电池。
第二节 化学电源
[知识要点]
化学电源是将化学能转化为电能的装置,它包括一次电池、二次电池和燃料电池等几大类。
1、
 如左图:若在上述f装置中接上检流计并插入盐桥(盐桥通常是装有饱和KCl琼脂溶胶的U形管,溶液不致流出来,但离子则可以在其中自由移动)。检流计指针偏转,说明有电流通过。从检流计指针偏转的方向可以知道电流的方向是Cu极→Zn极。根据电流是从正极流向负极,因此,Zn极为负极,Cu极为正极。电子从Zn极→Cu极。
2、若取出盐桥,检流计指针归零,重新放入盐桥,指针又发生偏转,说明盐桥起 到了使整个装置构成通路的作用。
盐桥是怎样构成原电池中的电池通路呢?
Zn棒失去电子成为Zn2+进入溶液中,使ZnSO4溶液中Zn2+过多,带正电荷。Cu2+获得电子沉积为Cu,溶液中Cu2+过少,SO42-过多,溶液带负电荷。当溶液不能保持电中性,将阻止放电作用的继续进行。盐桥的存在,其中Cl-向ZnSO4 溶液迁移,K+向CuSO4
溶液迁移,分别中和过剩的电荷,使溶液保持电中性,反应可以继续进行。盐桥中离子的定向迁移构成了电流通路,盐桥既可沟通两方溶液,又能阻止反应物的直接接触。
4、电极名称及其判断:
(1)根据电极材料:两种金属(或金属与非金属)组成电极,若它们都与(或都不与)电解质溶液单独能反应,则较活泼的金属作负极;若只有一种电极与电解质溶液能反应,则能反应的电极作负极。
(2)根据电极反应:失电子--氧化反应--负极
得电子--还原反应--正极
(3)根据电子或电流流动方向(外电路):
电子从负极流出
流入正极,电流从正极流出
流入负极,(4)根据离子的定向移动(内电路):阳离子向 移动
阴离子向 移动
练习2:请判断下列原电池的正负极:
如左图:若在上述f装置中接上检流计并插入盐桥(盐桥通常是装有饱和KCl琼脂溶胶的U形管,溶液不致流出来,但离子则可以在其中自由移动)。检流计指针偏转,说明有电流通过。从检流计指针偏转的方向可以知道电流的方向是Cu极→Zn极。根据电流是从正极流向负极,因此,Zn极为负极,Cu极为正极。电子从Zn极→Cu极。
2、若取出盐桥,检流计指针归零,重新放入盐桥,指针又发生偏转,说明盐桥起 到了使整个装置构成通路的作用。
盐桥是怎样构成原电池中的电池通路呢?
Zn棒失去电子成为Zn2+进入溶液中,使ZnSO4溶液中Zn2+过多,带正电荷。Cu2+获得电子沉积为Cu,溶液中Cu2+过少,SO42-过多,溶液带负电荷。当溶液不能保持电中性,将阻止放电作用的继续进行。盐桥的存在,其中Cl-向ZnSO4 溶液迁移,K+向CuSO4
溶液迁移,分别中和过剩的电荷,使溶液保持电中性,反应可以继续进行。盐桥中离子的定向迁移构成了电流通路,盐桥既可沟通两方溶液,又能阻止反应物的直接接触。
4、电极名称及其判断:
(1)根据电极材料:两种金属(或金属与非金属)组成电极,若它们都与(或都不与)电解质溶液单独能反应,则较活泼的金属作负极;若只有一种电极与电解质溶液能反应,则能反应的电极作负极。
(2)根据电极反应:失电子--氧化反应--负极
得电子--还原反应--正极
(3)根据电子或电流流动方向(外电路):
电子从负极流出
流入正极,电流从正极流出
流入负极,(4)根据离子的定向移动(内电路):阳离子向 移动
阴离子向 移动
练习2:请判断下列原电池的正负极:
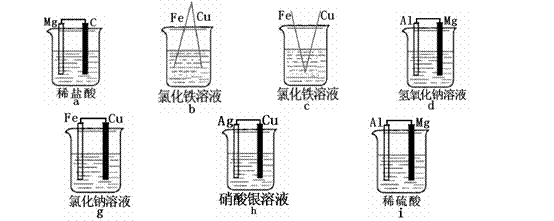
3、组成原电池的条件:
a 、有两种活泼性不同的金属作电极(或金属与能导电的非金属或化合物)
注意:燃料电池中两极可同选石墨或铂
b 、有电解质溶液
c 、构成闭合的回路
d 、能自发发生氧化还原反应
 练习1:下列哪些装置能组成原电池?( )
练习1:下列哪些装置能组成原电池?( )

2、实质:将氧化还原反应的电子转移变成电子的定向移动。即将化学能转化成电能
1、原电池定义:将 转变为 的装置。
8.有PH为13的Ba(OH)2、NaOH的混合溶液100mL,从中取出25mL用0.025mol/LH2SO4滴定,当滴定至沉淀不再增加时,所消耗的酸的体积是滴定至终点所耗酸体积的一半。求:
(1)当滴到沉淀不再增加时,溶液的pH(设体积可以加和)
(2)原混合溶液中Ba(OH)2和NaOH的物质的量浓度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com