
3.按要求写出下列水溶液中水解的化学方程式和离子方程式,并判断溶液的酸碱性,
(1) 硫酸铁:
(2)明矾
(3)硝酸铵
(4)硫酸铜
(5)氯化镁
(6)硅酸钠
(7)碳酸钾
(8) 碳酸氢钡
(9)偏铝酸钠
(10)次氯酸钠
(11)硫化钠
(12)NaCN
(13)K2C2O4(草酸钾、乙二酸钾)
(14)磷酸钠
水溶液呈酸性的是
水溶液呈碱性的是
2.下列式子属于水解反应,且溶液呈酸性是 ( )

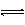 (A)HCO3-+H2O H3O++CO32-
(A)HCO3-+H2O H3O++CO32-
(B)Fe3++3H2O Fe(OH)3+3H+

 (C)HS-+H2O
H2S+OH-
(C)HS-+H2O
H2S+OH-
(D)NH4++H2O NH3·H2O+H+
1.下列物质溶解于水时,电离出的阴离子能使水的电离平衡向右移动的是( )
(A)CH3COONa (B)Na2SO4 (C)NH4Cl (D)H2SO4
3、实质:复分解反应
盐+水 酸+碱 (中和反应的逆反应)
酸+碱 (中和反应的逆反应)
中和反应 热,所以水解 热.
中和反应程度 ,所以水解程度 (较大、较小),书写水解方程式时要用可逆符号.
由于程度较小一般不标明气体,沉淀符号.
另:多元弱酸根离子分步水解,以 为主(除SiO32-外),都要分步写.
要求:能够判断是否是水解反应,要能够书写水解的化学方程式和离子方程式
2、生成弱酸或弱碱(难电离微粒)
的反应..
1、必须在 中,不溶于水的部分不考虑.
溶液呈酸、碱性取决于 .
强酸强碱盐溶液中没有任何因素使c(H+)和c(OH-)不相等,因此强酸强碱盐溶液呈 性.
任何水溶液中都存在水的电离平衡 .
强酸弱碱盐在水溶液中完全电离,电离出 阳离子和 阴离子,则强酸弱碱盐电
离出来的 离子和水电离出来的 离子结合成
使H2O的电离平衡向 方向移动,到达新平衡时c(H+) c(OH-),溶液呈 性.
例:NH4Cl溶液: 水微弱电离,电离出 和
NH4Cl在水溶液中完全电离,电离出 和
NH4Cl电离出的 和水电离出的 结合生成 , 使H2O的电离平衡向
方向移动,到达新平衡时c(H+) c(OH-),溶液呈 性.
化学方程式
离子方程式
NH4Cl水溶液存在的微粒有 种,分别是 .
强碱弱酸盐在水溶液中完全电离,电离出 阳离子和 阴离子,则强碱弱酸盐电
离出来的 离子和水电离出来的 离子结合成 (或 )
使H2O的电离平衡向 方向移动,到达新平衡时c(H+) c(OH-),溶液呈 性.
例: CH3COONa在水溶液中完全电离,电离出 和
CH3COONa电离出的 和水电离出的 结合生成 , 使H2O的电离平衡向
方向移动,到达新平衡时c(H+) c(OH-),溶液呈 性.
化学方程式
离子方程式
CH3COONa水溶液存在的微粒有 种,分别是 .
2.任何一种盐都可以看作是 和 反应的产物,按生成盐的酸和碱的强弱可以把盐分为:
水溶液呈 性
水溶液呈 性
水溶液呈 性
弱酸弱碱盐 水溶液的酸碱性要看弱酸和弱碱的相对强弱。(谁强显谁性)
要求:能够根据化学式判断盐的种类,进而推出前三种盐溶液的酸碱性
(1)常见的强酸有 、 、 、 、 、 。
(1)常见的强碱有 、 、 、 。(另第IA族的铷、铯, 第IIA族的锶对应的碱)
例题:实验室有下列试剂:①NaOH溶液 ②水玻璃 ③Na2S溶液 ④NH4Cl溶液 ⑤浓H2SO4,其中必须用带橡胶塞的试剂瓶保存的是 ( )
A、①④⑤ B、①②③ C、①②④ D、②④⑤
4、 电冶金
对于 、 、 、 这样活泼的金属,工业上用电解法冶炼。
工业上用电解 的方法制取金属钠,方程式
工业上用电解 的方法制取金属镁,方程式
工业上用电解 的方法制取金属铝,方程式
练习:电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:

(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
① 电解池中X极上的电极反应式为 。在X极附近观察到的现象是 。
② Y电极上的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
① X电极的材料是 ,电极反应式是 。
② Y电极的材料是 ,电极反应式是 。
(说明:杂质发生的电极反应不必写出)
3、 铜的精炼
电解时,通常把 作阴极,把 作阳极,
用含有 作电镀液。
粗铜中的多数杂质沉积在电解槽底部,形成
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com