
3.0.1mol/L的Na2S溶液中,有关粒子的浓度大小关系正确的是
(A)c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-)
(B)c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-)
(C)c(Na+)=2c(S2-)+2c(HS-)+2c(H2S)
(D)c(Na+)=2c(S2-)+2c(HS-)+2c(H2S)
2.某二元酸(化学式用H2B表示)在水中的电离方程式是: H2B H+ + HB– ,
HB– H+ + B2– 。回答下列问题:
H+ + B2– 。回答下列问题:
(1)Na2B溶液显_______ __(填“酸性”,“中性”,或“碱性”)。
理由是______________________________ ____(用离子方程式表示)。
(2)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是__________。
A、c (B2– ) + c (HB– ) + c (H2B) = 0.1 mol/L B、c (Na+ ) + c (OH– ) = c (H+) + c (HB– )
C、c (Na+ ) + c (H+ ) = c (OH – ) + c (HB– ) + 2c (B2 – ) D、c (Na+ ) = 2c (B 2– ) + 2c (HB–)
CH3COONa + H2O CH3COOH +
NaOH
CH3COOH +
NaOH
CH3COO- + H2O  CH3COOH + OH-
CH3COOH + OH-
以醋酸钠溶液为例说明:(填>,< ,=)
溶液呈电中性,所以溶液中n(正电荷)= n(负电荷)
即:n(Na+)+ n(H+) n(CH3COO-)+ n(OH-)(两边同时除以体积)
即:电荷守恒:c(Na+)+c(H+)= c(CH3COO-)+ c(OH-)
CH3COONa固体中,n(Na+) n(CH3COO-)
但在CH3COONa溶液中,因为CH3COO-)水解,所以 n(Na+) n(CH3COO-)
即 c(Na+) c(CH3COO-);根据CH3COONa固体中,n(Na+) n(CH3COO-)
所以该溶液中n(Na+) n(CH3COO-) + n(CH3COOH),(两边同时除以体积)
即:物料守恒:c(CH3COOH)+ c(CH3COO-)=c(Na+)
将上述两式相加得到以下关系:
质子守恒:c(OH-)= c(H+)+ c(CH3COOH)
质子守恒:根据水电离出的c(OH-)= c(H+),溶液中的H+或OH-虽与其他离子结合而以不同的形式存在,但其总量相同,
练习:
1.写出下列溶液中的三种守衡关系。
(1)碳酸钠
电荷守恒:
物料守恒:
质子守恒:
(2)硫化钾
电荷守恒:
物料守恒:
质子守恒:
(3)磷酸钠
电荷守恒:
物料守恒:
质子守恒:
4.有A、B、C、D、E五种溶液,其中的阳离子分别是Ag+、Na+、Ba2+、Al3+、Fe3+,阴离子分别为Cl-、OH-、NO3-、CO32-、SO42-(都不重复),现进行如下实验:
(1)C溶液中加入纯铁粉,溶液质量增加;
(2)A、E溶液都呈碱性,测得0.1mol/L的A溶液pH小于0.1mol/L的E溶液;
(3)在B溶液中逐滴加入氨水,出现沉淀,继而沉淀消失;
(4)在D溶液中加入硝酸钡溶液,无明显现象。
据此推断各溶液的成分:A为 ;B为 ;C为____________;D为____________;E为____________;
3.下列叙述中错误的是
(A)配制FeCl3溶液,为了抑制水解,常加入盐酸 (B)盐类都能水解
(C)盐类的水解反应,通常是吸热反应
(D)盐类水解是指组成盐的离子跟水电离出来的H+或OH-生成弱电解质的反应
(1)内因-
(2)外因:
例: 以FeCl3水解为例:
FeCl3水解离子方程式
|
条件变化 |
对水解方向的影响 |
c(Fe3+) |
c(H+) |
pH |
现象 |
水解程度(水解百分率) |
|
升高温度 |
|
|
|
|
|
|
|
加水 |
|
|
|
|
|
|
|
加FeCl3(S) 或浓FeCl3(aq) |
|
|
|
|
|
|
|
加入镁粉 |
|
|
|
|
|
|
|
加盐酸 |
|
|
|
|
|
|
|
加NaOH(S) |
|
|
|
|
|
|
|
加入Na2CO3(S)或NaHCO3(S) |
|
|
|
|
|
|
|
加入NaHSO4(S) |
|
|
|
|
|
|
|
加入NaCl(S) |
|
|
|
|
|
|
练习:CH3COONa的水解
水解离子方程式
|
条件变化 |
c(CH3COO-) |
c(CH3COOH) |
c(OH-) |
c(H+) |
pH |
水解程度 |
|
升高温度 |
|
|
|
|
|
|
|
加水 |
|
|
|
|
|
|
|
加醋酸 |
|
|
|
|
|
|
|
加醋酸钠 |
|
|
|
|
|
|
|
加盐酸 |
|
|
|
|
|
|
|
加NaOH(S) |
|
|
|
|
|
|
推广:
①浓度:增大盐的浓度,水解平衡向 移动,但水解程度 。道理与化学平衡相似,增大某反应物浓度,平衡向 移动,但该反应物转化率一般要 。减小盐的浓度(加水稀释),平衡向 移动。如CO32-+H2O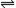 HCO3-+OH-,加水稀释c(HCO3-)、c(OH-)均 。故盐的浓度越大,水解程度 ,但对应的离子浓度 。
HCO3-+OH-,加水稀释c(HCO3-)、c(OH-)均 。故盐的浓度越大,水解程度 ,但对应的离子浓度 。
溶液的酸碱性:
对于水解呈酸性的溶液加酸 水解,加碱 水解。
对于水解呈碱性的溶液加酸 水解,加碱 水解。(填促进、抑制)
(如a、FeCl3溶液在配制时加入盐酸,抑制其水解。
b、等物质的量浓度的NH4HSO4和NH4Cl溶液,c(NH4+)显然是NH4HSO4大于NH4Cl。)
②温度:温度越高,水解程度 。因盐类水解是中和反应的 ,中和反应均为放热反应,水解反应一定 。
(如制备Fe (OH)3胶体利用了温度对盐类水解的影响。)
③同种元素阳离子的化合价--价高者解程度更大,如Fe3+>Fe2+
习题:1.在6份0.01mol/L氨水中分别加入下列各物质:A.浓氨水B.纯水 C.少量K2CO3
D.少量H2SO4 E.少量NaOH固体 F.少量Al2(SO4)3固体
(1)能使c(OH-)减小、c(NH4+)增大的是_______
(2)能使c(OH-)增大、c(NH4+)减小的是_______
(3)能使c(OH-)和c(NH4+)都增大的是_________
(4)能使c(OH-)和c(NH4+)都减小的是_________
2.有四种一元酸HA、HB、HC、HD,相同物质的量浓度的NaD和NaB溶液的pH,前者比后者大,NaA溶液呈中性,1mol/L的KC溶液遇酚酞试液呈红色;同体积、同物质的量浓度的HB、HC用样的装置分别作导电性试验,发现后者的灯泡比前者亮,则这四种酸的酸性由强到弱的顺序为________________________。
(水解规律)(无弱不水解)有弱才水解,都弱双水解,
越弱越水解(都强显中性)谁强显谁性。
注意:①有弱还要看溶不溶,不溶也不一定不水解。(如MgCO3也水解,但是FeS不水解。)
②中和反应一般是完全进行的,所以有弱电解质参与的中和反应的逆反应,其水解反应程度很小,用可逆符号。
③谁强显谁性,都强不水解显中性,都弱看水解的相对强弱。
④多元弱酸的酸式酸根看电离与水解的相对强弱。
(HSO3-和H2PO4-,电离程度>水解程度,所以NaHSO3和Na H2PO4的水溶液呈酸性,其他弱酸的酸式盐一般水溶液呈碱性)
例题:将0.05mol下列物质置于500mL水中,充分搅拌后,溶液中阴离子数目最多的是( )
A、NH4Br B、K2SO4 C、Na2S D、Mg(OH)2
7.一定温度下,甲、乙两瓶氨水的浓度分别为1mol/L和0.1mol/L,则甲、乙两瓶氨水中
c(OH-)之比为 ( )
A. 大于10 B. 小于10 C. 等于10 D. 无法确定
第三节 盐类的水解(课时3、4)
5. pH值为3的CH3COOH和pH为11的NaOH溶液等体积混合,混合后溶液pH为( )
A. pH>7 B. pH< 7 C. pH=7 D.无法判断
4.写出离子方程式
(1)将NH4Cl加入到重水中 。
(2)由FeCl3制Fe(OH)3胶体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com