
6.燃料电池是目前正在探索的一种新型电池,现在已经使用的氢氧燃料电池的基本反应是:x 极:O2(g) + 2H2O(l) + 4eˉ→ 4OHˉ y极:2H2(g) + 4OHˉ→ 4H2O(l) + 4eˉ
判断下列说法中正确的是
A.x极发生氧化反应 B.x极是负极
C.y极发生氧化反应 D.电子由x极流向y极
5.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电流总反应式为:
Zn(s) + 2MnO2(s) + H2O(l) = Zn(OH)2(s) + Mn2O3(s) 下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e- =Mn2O3(s)+2OH- (aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g
4.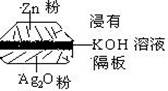 如图为一种钮扣微型电池,其电极分别为Ag2O和Zn,电解质溶液是KOH溶液,俗称银锌电池,该电池的总反应式为:
Zn +Ag2O = ZnO+2Ag
如图为一种钮扣微型电池,其电极分别为Ag2O和Zn,电解质溶液是KOH溶液,俗称银锌电池,该电池的总反应式为:
Zn +Ag2O = ZnO+2Ag
根据以上提供的资料,判断下列说法正确的是
A.锌为正极,Ag2O为负极
B.放电时正极附近溶液的pH升高
C.放电时负极附近溶液的pH升高
D.溶液中阴离子向正极方向移动,阳离子向负极方向移动
3.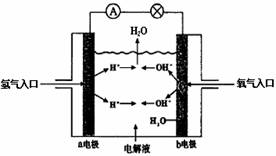 下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是
下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是
A. a电极是负极
B.b电极的电极反应为:
4OH--4e- =2H2O+O2
C. 氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
2.锌锰干电池在放电时电池总反应方程式可以表示为:
Zn + 2 MnO2 + 2NH4+ = Zn2+ + Mn2O3 + 2 NH3 + H2O
在此电池放电时,正极(碳棒)上发生反应的物质是 A.MnO2和NH4+ B.Zn2+和NH4+ C.Zn D.碳棒
1.银锌蓄电池的电极反应为:Zn + 2 OHˉ- 2eˉ= ZnO + H2O,
Ag2O + H2O + 2 eˉ= 2Ag + 2OHˉ。据此判断,氧化银是
A.负极,并被氧化 B.正极,并被还原
C.负极,并被还原 D.正极,并被氧化
13.电极和电解质溶液;负;正;化学;电能;电能;化学能;氧化还原;14.(1)镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转;正极:2H++2e-=H2↑ 负极:Mg-2e-=Mg2+ 化学能、电能;(2)Al;2Al+2NaOH+2H2O=2NaAlO2+3H2↑
15(1)电解前AgNO3的溶液质量为1000g。电解析银108g。;(2)AgNO3的溶解度20.5g。(3)电解后HNO3的百分比浓度为7.1%,物质的量浓度为1.17mol/L。
15. 用Pt电极电解饱和AgNO3溶液(百分比浓度为17%),金属银完全析出时,阳极上放出5.6L气体(标况),电解后溶液的密度为1.038g/cm3。
求: (1)电解前AgNO3溶液的总质量是多少?电解析出多少g Ag?
(2)电解前AgNO3的溶解度是多少?
(3)电解后所得溶液的百分比浓度和物质的量浓度各是多少?
1-6BDCABD;7-12CCCDDD;
14. 如图所示装置:
如图所示装置:
(1)若烧杯中溶液为稀硫酸,则观察到的现象为
。
两极反应式为:正极 ;
负极 。
该装置将 能转化为 能。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为 ,
总反应方程为 。
13.原电池由__________ _______组成。较活泼的金属是_____极,较不活泼的金属(或能导电的非金属)是_______极。原电池是把______能转化为________能的装置。电解池是把______能转化为________能的装置。在能量转化过程中,都发生了__________反应。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com