
7.铁在下列情况下腐蚀最快的是
A.铁放在海水中 B.铁和锌连接放入水中
C.铁和锡连接放入海水中 D.铁和锡连接放入淡水中
6.为保护地下钢管不受腐蚀,可采用的方法是
A. 将它与直流电源的负极相连接 B. 将它与交流电源相连接
C. 将它与Cu板相连接 D. 将它与Zn板相连接
5.钢铁的锈蚀过程中,下列五种变化可能发生的是:(1)Fe由+2价转化为+3价;(2)O2被还原;(3)H+ 被还原;(4)有Fe2O3·H2O生成;(5)杂质碳被氧化除去
A.(1)(2) B.(3)(4)
C.(1)(2)(3)(4) D.(1)(2)(3)(4)(5)
4.下列各装置中都盛有0.1 mol·Lˉ1 的NaCl溶液,放置一定时间后,锌片的腐蚀速率由快到慢的顺序是
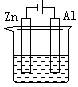
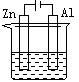
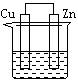

① ② ③ ④
A.③①④② B.①②④③ C.①②③④ D.②①④③
3.金属及其制品在腐蚀介质中很容易被腐蚀,其使用寿命大为降低。因此只有对腐蚀介质中的金属及其制品采取防护措施,才能保证金属工艺设备的安全性和工农业生产的顺利进行。下面对金属及其制品的防护措施中错误的是
A.铁锅用完后,用水刷去其表面的油污,置潮湿处保存
B.通过特殊工艺,增加铝制品表面的氧化膜
C.对于易生锈的铁制品(如防护网)要定期涂刷防护漆
D.把Cr、Ni等金属加入到普通钢里制成不锈钢
2.在电子工业中,制印刷电路时,常用氯化铁溶液作为铜的“腐蚀液”,该过程发生的反应为:2FeCl3+Cu=2FeCl2+CuCl2。该反应利用了铜的什么性质 A .氧化性 B.还原性 C.导电性 D. 导热性
1.2000年5月,保利集团在香港拍卖会上花费3000多万港币购回在火烧圆明园时流失的国宝:铜铸的牛首、猴首和虎首。普通铜器时间稍久容易出现铜绿,其主要成分是Cu2(OH)2CO3 。这三件1760年铜铸的国宝在240年后看上去仍然熠熠生辉不生锈,下列对其原因的分析,最可能的是
A.它们的表面都电镀上一层耐腐蚀的黄金
B.环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去
C.铜的金属活动性比氢小,因此不易被氧化
D.它们是含一定比例金、银、锡、锌的铜合金
13.为省药品和时间,甲、乙、丙三位同学用铜片、锌片、稀硫酸、CuSO4溶液;直流电源、石墨电极、导线、烧杯、试管等中学化学常见的药品和仪器(用品),以巧妙的构思,“接力”的方式,设计了比较铜与锌金属活动性相对强弱的系列实验。试填写下列空白:
(1)甲同学分别将一小片铜片、锌片置于烧杯底部(铜与锌不接触),小心向烧杯中加入稀硫酸,观察到的现象是 。甲同学的设计思路是 。
(2)乙同学接着甲的实验,向烧杯中滴加 溶液,进而观察到的现象是 。
乙同学作出锌、铜金属活动性相对强弱所依据的原理是 。
(3)丙同学使用直流电源、石墨电极组装好电解装置,向乙同学实验后的溶液中补充了必要的试剂(作为电解液)。反应在调控下随即开始,实验中有关化学反应方程式为
。
获得的实验明显现象是 。
(4)请你再单独设计一个简单的实验(试剂、仪器自选),探究和证实锌和铜的金属活动性的相对强弱(简要说明操作和现象)
;
12. 菜刀上沾有食盐水后,置于空气中一段时间会生锈,其原理是
正极 负极
A .Fe-2eˉ= Fe2+ 2H2O+O2+4eˉ= 4OHˉ
B.2H++2eˉ= H2 Fe-2eˉ= Fe2+
C.2H2O+O2+4eˉ = 4OHˉ Fe-3eˉ= Fe3+
D.2H2O+O2+4eˉ = 4OHˉ Fe-2eˉ= Fe2+
11.白铁皮发生析氢腐蚀,有0.2mol电子发生转移,下列说法不正确的是
A.有6.5g锌被腐蚀 B.2.8g铁被腐蚀
C.正极上H+被还原 D.在标准状况下有2.24L气体放出
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com