
11、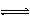 可逆反应:3 A ( g
) 3 B
( ? ) + C ( ? ) △H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是:①B和C可能都是固体; ②B和C一定都是气体;③若C为固体,则B一定是气体;
④B和C可能都是气体;
可逆反应:3 A ( g
) 3 B
( ? ) + C ( ? ) △H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是:①B和C可能都是固体; ②B和C一定都是气体;③若C为固体,则B一定是气体;
④B和C可能都是气体;
A.①② B.②③ C.③④ D.①④
10、氨水中有下列平衡 NH3·H2O 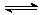 NH4++OHˉ 当其它条件不变时,改变下列条件,平衡向左移动,且NH4+浓度增大的是
NH4++OHˉ 当其它条件不变时,改变下列条件,平衡向左移动,且NH4+浓度增大的是
A.加NaOH B.加HCl C.加NH4Cl D.加同浓度的氨水
8、在恒温恒容的容器中进行反应H2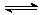 2H △H>0,若反应物浓度由 0.1 mol·Lˉ1降到0.06 mol·Lˉ1需2s,那么由0.06 mol·Lˉ1降到0.024 mol·Lˉ1需要反应时间为
2H △H>0,若反应物浓度由 0.1 mol·Lˉ1降到0.06 mol·Lˉ1需2s,那么由0.06 mol·Lˉ1降到0.024 mol·Lˉ1需要反应时间为
A.等于18s B.等于 12s C.大于18s D.小于18s 9、下列有关化学反应速率的说法正确的是
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B.100mL2 mol·Lˉ1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速度不变
C.SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
7、把HI气体充入密闭容器中,在一定条件下发生反应:
2HI(g)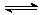 H2(g)+I2(g),在反应趋向平衡状态的过程中,下列说法正确的是
H2(g)+I2(g),在反应趋向平衡状态的过程中,下列说法正确的是
A.HI的生成速率等于其分解速率
B.HI的生成速率小于其分解速率
C.HI的生成速率大于其分解速率
D.无法判断HI的生成速率和分解速率的相对大小
6、下列四个数据是在不同条件下测出的合成氨反应的速率,其中最快的是
A.V(H2)=0.1 mol·Lˉ1·minˉ1 B.V(N2)=0.1 mol·Lˉ1·minˉ1
C.V(NH3)=0.15 mol·Lˉ1·minˉ1 D.V(N2)=0.002 mol·Lˉ1·sˉ1
3、在化学反应A(g)+ 3B(g) 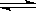 2C(g)+ D(g)中,各物质的平均反应速率间的关系式正确的是
2C(g)+ D(g)中,各物质的平均反应速率间的关系式正确的是
A.vA=vB B.vA=2vC C.3vB=vC D.vB=3vD 4、本题列举的四个选项是4位同学在学习“化学反应的速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是:
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品 5、用铁片与稀硫酸反应制取氢气时,下列措施能使氢气生成速率加大的是
A.加少量CH3COONa固体 B.加水
C.不用稀硫酸,改用98%浓硫酸 D.不用铁片,改用铁粉
2、 能使碳酸钙的分解速率显著增大的措施是:
A.增加少量的CaCO3 固体 B.升高温度 C.加入MnO2 D.增大压强
1、在2A+B
 3C+4D反应中,表示该反应速率最快的是(mol·Lˉ1·sˉ1)
3C+4D反应中,表示该反应速率最快的是(mol·Lˉ1·sˉ1)
A.v(A)=0.5 B.v(B)=0.3 C.v(C)=0.8 D.v(D)=1
16.气态可逆反应mA(g)+nB(g)  pC(g)+qD(g),符合图2-27,试用“>”或“<”填(1)-(4)题.
pC(g)+qD(g),符合图2-27,试用“>”或“<”填(1)-(4)题.

图2-27
(1)温度T1________T2.
(2)压强p1________p2.
(3)m+n________p+q.
(4)正反应为__________________反应(填“放热”或“吸热”).
解析:(1)T1时比T2时先到达平衡,因此,T1>T2.
(2)P2时比P1时先到达平衡,因此,P2>P1.
(3)P2时B%小于P1时B%,因此,m+n>p+q.
(4)T1时C%大于T2时C%,因此,正反应吸热.
答案:(1)> (2)< (3)> (4)吸热
12。(1)变深 Mg与盐酸反应放热,所以A中气体温度升高.2NO2 N2O4(正反应为放热反应),平衡向左移动,NO2浓度增大,颜色加深;(2)变浅 NH4Cl与晶体氢氧化钡反应吸热,使B中气体温度降低,上述平衡向右移动,NO2浓度减小,颜色变浅
N2O4(正反应为放热反应),平衡向左移动,NO2浓度增大,颜色加深;(2)变浅 NH4Cl与晶体氢氧化钡反应吸热,使B中气体温度降低,上述平衡向右移动,NO2浓度减小,颜色变浅
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com