
1.下列液体中pH>7的是
A.人体血液 B.蔗糖溶液 C.橙汁 D.胃液
18.已知在90℃时,纯水的c(H+)约为10ˉ6 mol·Lˉ1,此时溶液的pH是 ,这种水显 性(酸性或碱性或中性),其理由是 。在该温度下水的离子积常数为 。
1-6BCDCDC;7-12CACBCD;13.弱,水溶液,KW= c(H+)·c(OH-);14.k= c(H+)·c(HCOO-)/c(HCOOH) k= c(H+)·c(CN-)/c(HCN),不相等。因为HCOOH和 HCN的酸性强弱不同,所以它们在水中的电离程度不同,电离常数也不同。15.1.8×10-13 16.= 17.已知室温时,纯水中c(H+)= c(OH-)=10-7 mol/L,又因水的电离是吸热反应。温度升高到80℃电离度增大,致使c(H+)= c(OH-)>10-7 mol/L。即pH <7;18.=6,中性,
c(H+)= c(OH-) 1×10-12
17.在80℃时,纯水的pH <7,为什么?
16.常温下.将等体积的氨水与盐酸混合后,c(NH4+)= c(Clˉ),则溶液的pH 7(填>.<.=)
15.某温度时,水的离子积常数为1.8×10ˉ14,则0.1 mol·Lˉ1的盐酸中由水电离产生的c(H+)等于 。
14.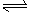
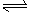 HCOOH H++ HCOOˉ,HCN H++ CNˉ,它们的电离常数的表达式分别为
,
,
当它们的浓度.温度均相等时,它们的电离平衡常数 (填相等或不相等)
HCOOH H++ HCOOˉ,HCN H++ CNˉ,它们的电离常数的表达式分别为
,
,
当它们的浓度.温度均相等时,它们的电离平衡常数 (填相等或不相等)
13.水是一种 的电解质,无论在 或纯水中,都存在的电离平衡,水的离子积常数指 ,它只随 的变化而变化。25℃时,KW为 ;100℃时,
KW为 。
12.在0.1 mol·Lˉ1氨水和0.1 mol·Lˉ1氯化铵的混合溶液中,氨水的电离平衡常数为
Kb = c(NH4+)·c(OHˉ)/c(NH3·H2O),则
A.c(NH4+)= c(OHˉ)= c(NH3·H2O) B.c(NH4+) = c(OHˉ)>c(NH3·H2O)
C.c(NH3·H2O)>c(NH4+)>c(OHˉ) D.c(NH4+)>c(OHˉ)
11.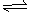 CH3COOH的电离平衡常数为:CH3COOH H++
CH3COOˉ,
CH3COOH的电离平衡常数为:CH3COOH H++
CH3COOˉ,
Ka= c(H+)·c(CH3COOˉ)/c(CH3COOH )则
A.c(H+)=c(CH3COOˉ)=c(CH3COOH ) B.c(H+)=c(CH3COOˉ)>c(CH3COOH )
C.c(H+)=c(CH3COOˉ)<c(CH3COOH ) D.c(CH3COOˉ)=c(CH3COOH )≠c(H+)
10.温度不变,稀释弱电解质溶液时,有关Ka、Kb的叙述正确的是
A.Ka、Kb分别减小,但数值不一定相同 B.Ka、Kb均不变
C.Ka、Kb均增大 D.其中之一可能发生变化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com