
3.下列物质能导电的是:①固体食盐;②溴水;③CuSO4·5H2O;④液溴;⑤蔗糖;⑥氯化氢气体;⑦盐酸;⑧液态氯化氢
A.①④⑤ B.②⑦ C.⑤⑥⑧ D.④⑧
2.在同一温度下,弱电解质溶液a,强电解质溶液b,金属导体c的导电能力相同,若升高温度后,它们的导电能力是
A.a>b>c B.a=b=c C.c>a>b D.b>c>a
1.关于强.弱电解质的叙述不正确的是
A.强电解质在溶液中完全电离,不存在电离平衡
B.同一弱电解质溶液,温度不同时,导电能力不同
C.强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱
D.强电解质在固态或液态时,可能不导电
12、解析:
在MgCO3的饱和溶液中,MgCO3沉淀溶解平衡:MgCO3(s)  Mg2+ + CO32-
Mg2+ + CO32-

同时存在CO32-水解平衡:CO32-+
H2O  HCO3- + OH-
HCO3- + OH-

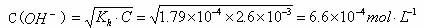

在Mg(OH )2的饱和溶液中
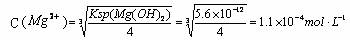
因为Qc > Ksp(Mg(OH) 2),所以有Mg(OH) 2沉淀析出。即加热后,MgCO3沉淀转化为Mg(OH) 2。硬水加热后水垢主要成分是CaCO3和Mg(OH)2而不是CaCO3 和MgCO3。
11、解:只有当 Qc > Ksp时,离子才能生成沉淀。
混合后:[Ag+]=2 ×10-3mol·L-1,[Cl-]= 2 ×10-3mol·L-1
Qc=[Ag+][Cl-]=2 ×10-3mol·L-1 × 2 ×10-3mol·L-1 =4.0 ×10-6mol2·L-2 >1.8×10-10mol2·L-2 Qc>Ksp,所以有AgCl沉淀析出。
10、解析:Fe3+沉淀完全时,其浓度为1×10-5 mol.L-1,根据 Ksp[Fe(OH)3 ]可算出溶液中[OH-],求出此时pH,再通过 Ksp[Fe(OH)2]求出Fe2+为0.050 mol.L-1时,OH- 的最大浓度,换算出pH即可求出满足要求的pH.
Fe3+沉淀完全时,[Fe3+]为1×10-5 mol.L-1,
[OH-]3= Ksp[Fe(OH)3 ]/ [Fe3+]=(1.1×10-36 / 1×10-5)=1.1×10-31 [OH-]=4.8×10-11 mol.L-1则Fe3+ 沉淀完全时所需的pH 为: pH = 14-pH[OH-] =14-10.3 = 3.7
Fe2+开始沉淀时所需 [OH-] 为: [OH-]2 = Ksp[Fe(OH)2]/ [Fe2+]=(1.64×10-14 / 0.050)
=3.28×10-15 mol.L-1
[OH-]=5.7×10-7 mol.L-1 pH = 14-pH[OH-] =14-6.2 = 7.8因此,溶液的pH控制在3.7-7.8之间,可使Fe3+沉淀完全而Fe2+不沉淀。
9、 AgI、AgCl、4.1×10-14mol/L
12、为什么在水垢中镁主要以Mg(OH)2沉淀形式存在,而不是以MgCO3沉淀的形式存在?
已知:Ksp[Mg(OH)2]=5.6×10ˉ12,Ksp(MgCO3)=6.8×10ˉ6 ,H2CO3电离常数
k2=5.5×10ˉ11
1-5CAA(AD)A;6、 减小 不变 减小 7、 Zn2+;Cd2+ 8、 10-7mol/L 2
11、将4×10ˉ3 mol·Lˉ1的AgNO3溶液与4×10ˉ3 mol·Lˉ1的NaCl溶液等体积混合能否有沉淀析出?Ksp(AgCl)= 1.8×10ˉ10mol2·Lˉ2
10、溶液中含有Fe3+和Fe2+,它们的浓度都是0.050 mol·Lˉ1;如果要求Fe3+沉淀完全而Fe2+不生成沉淀Fe(OH)2,需控制pH为何范围 已知:
Ksp[Fe(OH)3 ]=1.1×10ˉ36 (mol·Lˉ1)4、Ksp[Fe(OH)2]=1.64×10ˉ14 (mol·Lˉ1)3 (提示:当某离子浓度小于10ˉ5 mol·Lˉ1时可以认为该离子沉淀完全了)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com