
30.(1)配平氧化还原反应方程式:
__ C2O42- +__MnO4- +__H+= __CO2 +__Mn2++__H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25 mol·L-1NaOH溶液至20 mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为 mol;
②第二份溶液中滴加0.10 mol·L-1的酸性高锰酸钾溶液至16 mL时反应完全,此时溶液颜色由 变为 。该溶液中还原剂的物质的量为 mol;
③原试样中H2C2O4·2H2O和KHC2O4的质量分数分别是多少?
(请列式计算,写出运算过程)
29.(13分)A、B、C、D、E是原子序数依次增大的五种短周期元素。A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同。A与E形成的化合物化学式为AE,其分子中含18个电子。请回答下列问题:
(1)A和B两元素也可以形成18电子的化合物M,则M的电子式为 。
(2)由C和E所形成的化合物中含有的化学键是 ,该化合物属于 晶体(填晶体类型)。
(3)由A、B、C、D四种元素所形成的两种化合物相互之间反应的离子方程式为:
。
(4)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1∶1∶1,将该盐溶液
在空气中露置一段时间后(充分光照,不考虑水分的挥发),溶液的pH近似为7,
则该过程的总反应方程式为 。
28.(4分)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡,时溶液中c(NH4+) = c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。
27.(10分)(1)除去NaHCO3溶液中混有的少量Na2CO3可采取的方法是 。
A.通入二氧化碳气体 B.加入氢氧化钡溶液
C.加入澄清石灰水 D.加入稀盐酸
写出相应的离子方程式 。
(2)为了检验某含有 杂质的
杂质的 样品的纯度,现将
样品的纯度,现将 克样品加热,其质量
克样品加热,其质量
变为 g,则该样品的纯度(质量分数)是
。
g,则该样品的纯度(质量分数)是
。
A. B.
B. C.
C. D.
D.
(3)在Na2CO3 溶液中滴加几滴酚酞,溶液变红,请解释(用离子方程式) ;
相同温度,相同浓度的①Na2CO3②NaHCO3③NaOH溶液pH由小到大的顺序 。(填序号)
26.(8分)氨在国民经济中占有重要的地位,请参与下列探究。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。
C(s) + H2O(g) 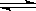 H2(g) + CO(g) △H =
+131.3 kJ ,△S = +133.7 J/K
H2(g) + CO(g) △H =
+131.3 kJ ,△S = +133.7 J/K
该反应在低温下能否自发 (填:能或否)。
(2)已知在400℃时,N2 (g)+ 3H2(g) 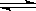 2NH3(g) △H<0 的K = 0.5;
2NH3(g) △H<0 的K = 0.5;
①2NH3(g) 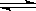 N2 (g) + 3H2(g)
的K=
(填数值)。
N2 (g) + 3H2(g)
的K=
(填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2 mol、1 mol、2 mol,则此时反应 v(N2)正 v (N2)逆(填:>、<、=、不能确定)
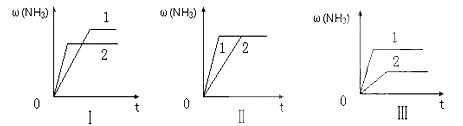
(3)在三个相同容器中各充入1 mol N2和3mol H2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是 (填序号) 。
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T
D.图Ⅱ可能是同温同压下,催化剂性能,1>2
25.某无色溶液中可能含有Na+、K+、Fe3+、NH4+、Cu2+、SO42-、SO32-、CO32-、Cl-、Br- 这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:①pH试纸检验,溶液的pH>7。②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,用分液漏斗分液。④向分液后的水溶液中加入Ba(NO3)2和HNO3溶液,有白色沉淀产生,过滤。⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生。则关于原溶液的判断中不正确的是
A.肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32-
B.肯定存在的离子是Na+、K+、SO32-、Br- 、Cl-
C.无法确定原溶液中是否存在Cl
D.若步骤④改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响。
Ⅱ卷(共45分)
24.高铁酸钾K2FeO4是一种新型、高效、氧化性比Cl2更强的水处理剂,工业上通常用下列反应先制得高铁酸钠:2FeSO4 + 6Na2O2 = 2Na2FeO4+2Na2O +2Na2SO4 +O2↑,然后在某低温下,在高铁酸钠溶液中加KOH固体至饱和就可析出高铁酸钾,下列有关说法不正确的是
A.Na2O2在反应中既作氧化剂,又作还原剂
B.制取高铁酸钠时,每生成l mol Na2FeO4反应中共有4 mol电子转移
C.高铁酸钾在该温度下的溶解度比高铁酸钠的溶解度小
D.K2FeO4能消毒杀菌,其还原产物水解生成的Fe(OH)3胶体能吸附水中的悬浮杂质
23.已知0.1 mol·L-1 的二元酸H2A溶液的pH=4.0,则下列说法中正确的是
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有:c(Na+) + c(H+) = c(HA-) + c(OH-) +2 c(A2-)
D.在Na2A溶液中一定有:c(Na+) > c(A2-) > c(H+) > c(OH-)
22.某温度下,w g某物质在足量氧气中充分燃烧,其燃烧产物立即与过量的Na2O2反应,固体质量增加w g。在①H2②CO ③CO和H2的混合气 ④HCHO ⑤CH3COOH ⑥HO-CH2-CH2-OH中,符合题意的是
A.均不符合 B.只有①②③
C.只有④⑤ D.全部符合
21.下列各组离子在指定条件下,一定能大量共存的是
A.能使红色石蕊试纸显蓝色的溶液:K+、Fe2+、SO42-、NO3-、Cl-
B.能使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+、S2-、Br-
C.pH=0的溶液中, 、
、 、
、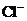 、
、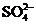
D.水电离产生c(H+) = 1×10-12 mol·L-1的溶液中,可能有Mg2+、Na+、Cl-、HCO3-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com