
3.(09广东化学15)取五等份NO2 ,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:
2NO2(g) N2O4(g),ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
( )
N2O4(g),ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
( )
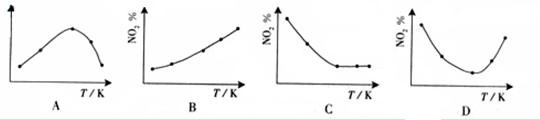
答案 BD
解析 在恒容状态下,在五个相同的容器中同时通入等量的NO2,反应相同时间。那么则有两种可能,一是已达到平衡状态,二是还没有达到平衡状态,仍然在向正反应移动。若5个容器在反应相同时间下,均已达到平衡,因为该反应是放热反应,温度越高,平衡向逆反应方向移动,NO2的百分含量随温度升高而升高,所以B正确。若5个容器中有未达到平衡状态的,那么温度越高,反应速率越大,会出现温度高的NO2转化得快,导致NO2的百分含量少的情况,在D图中转折点为平衡状态,转折点左则为未平衡状态,右则为平衡状态,D正确。
2.(09广东理科基础29)已知汽车尾气无害化处理反应为



 。
。
下列说法不正确的是 ( )
A.升高温度可使该反应的逆反应速率降低
B.使用高效催化剂可有效提高正反应速率
C.反应达到平衡后,N0的反应速率保持恒定
D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
答案 A
解析 升温,无论是正反应,还是逆反应,速率均加快,A项错;
催化剂可以加快化学反应速率,B项正确;
达平衡后,各组分的速率保持不变,C项正确;
由于CO和CO2的计量系数相等,故当两者同时消耗的量相等时,反应即达平衡,D项正确。
1.(09全国卷Ⅱ6) 物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是 ( )
A. 1:4 B.1:5 C. 2:3 D.2:5
答案 A
解析 设2molZn参与反应,因Zn无剩余,则最终生成了2molZn(NO3)2,显然含有4molNO3- ,这部分是没有参与氧化还原反应的HNO3,根据得失电子守恒有:2×n(Zn)=n(HNO3)×4,则n(HNO3)=1mol,即有1molHNO3被还原。
25.(2010浙江卷)(14分)洗车安全气囊是德国安全的重要保障。当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。为研究安全气囊工作的化学原理,取安全装置中的粉末进行实验。经组成分析,确定该粉末仅Na、Fe、N、O四种元素。水溶性试验表明,固体粉末部分溶解。经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸。
取13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L。单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另和一种单质。化合物丙与空气接触可转化为可溶性盐。
请回答下列问题:
(1)甲的化学式为 ,丙的电子式为 。
(2)若丙在空气中转化为碳酸氢盐,则反应的化学方程式为 。
(3)单质乙与红棕色粉末发生反应的化学方程式为 ,安全气囊中红棕色粉末的作用是 。
(4)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是 。
A. KCl B. KNO3 C. Na2S D. CuO
(5)设计一个实验方案,探究化合物丙与空气接触后生成可溶性盐的成分(不考虑结晶水合物) 。
试题解析:
本题知识载体很新鲜,很生活,很化学。简答式的题目首先要进行分析,确定设计的物质及反应才能完成各小题的内容。
题目关键词:粉末分解释放氮气,粉末仅含Na、Fe、N、O,水溶性试验部分溶解,可溶部分为化合物甲,不溶物红棕色可溶于盐酸。13.0g甲完全分解为N2和单质乙,N26.72L,单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另和一种单质。化合物丙与空气接触可转化为可溶性盐。
解题分析:1、粉末由两种物质混合而成。2、红棕色物质可能为Fe2O3\Fe(OH)3等,根据题意只能是Fe2O3。3、甲只有两种元素,且含N,必含Na。3、计算:N(6.72/22.4)*2*14=8.4g,则Na的物质的量为:(13-8.4)/23=0.2mol,N与Na的物质的量之比为:0.6:0.2=3:1,则化合物甲为Na3N。4、在高温下Na与Fe2O3反应的产物为Na2O2和Fe。
答案:(1)Na3N, (2)2N2O2+4CO2+2H2O=4NaHCO3+O2
(2)2N2O2+4CO2+2H2O=4NaHCO3+O2
(3)6Na+2Fe2O3=3Na2O2+4Fe
,红色粉末的作用是充当氧化剂,除去氮化钠分解产生的金属钠(金属钠溶于水产生大量的热和碱性有害物质),提供大量的热量用于氮化钠的迅速分解。(4)从氧化性角度分析KNO3、CuO均可,但KNO3本身受热分解,产生氧气与氮气反应。故选择D. CuO。(5)实验目的:检验Na2O2在空气中与水或二氧化碳反应的产物,即检验NaOH和Na2CO3或NaHCO3。实验设计一:实验原理:定量分析法。步骤:1、称量混合固体的质量。2、将混合物加热,并将气体通入澄清石灰水,无气体则无NaHCO3,石灰水变浑浊则有NaHCO3无NaOH,称量石灰水质量变化量mg。3、加入过量盐酸,将产生的气体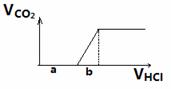 通入澄清石灰水,称量石灰水质量增加量ng。4、通过m与n的计算获得最终结果。实验设计二:实验原理:测定盐酸用量与产生二氧化碳的量的关系确定混合物成分。1、不产生二氧化碳则混合物只有NaOH。2、开始产生二氧化碳前,与开始产生二氧化碳直到最大量消耗的盐酸的体积比为1:1则只有Na2CO3。大于1:1则为NaOH与Na2CO3的混合物。小于1:1则为Na2CO3和NaHCO3的混合物。即比较图中a,b的大小。
通入澄清石灰水,称量石灰水质量增加量ng。4、通过m与n的计算获得最终结果。实验设计二:实验原理:测定盐酸用量与产生二氧化碳的量的关系确定混合物成分。1、不产生二氧化碳则混合物只有NaOH。2、开始产生二氧化碳前,与开始产生二氧化碳直到最大量消耗的盐酸的体积比为1:1则只有Na2CO3。大于1:1则为NaOH与Na2CO3的混合物。小于1:1则为Na2CO3和NaHCO3的混合物。即比较图中a,b的大小。
教与学提示:
题型的难点1是通过定性和定量两种方式确定物质的化学
成分,其中Na3N又是学生很不熟悉的。难点2是氧化还原方程式的书写与配平,及氧化还原原理的应用。难点3是实验设计,通过定量来定性。但,题目设计与问题设计都在平时的练习与讨论中必然会涉及。比如实验设计部分,在省市多次统考中均有有关碳酸盐与酸反应定量问题出现过,或反复练习过。但,在简答的环境中也还是有难度的。解题中要动用到平时知识的积累,决定成败还是在平时。
2009年高考题
27.(2010重庆卷)(15分)某兴趣小组用题27图装置探究氨的催化氧化.

(1)氨催化氧化的化学方程式为___________________.
(2)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是_________反应(填“吸热”或“放热”).
(3)为保证在装置4中观察到红棕色气体,装置3应装入_________;若取消3,在4中仅观察到大量白烟,原因是___________________.
(4)为实现氨催化氧化,也可用装置5替换装置_________(填装置代号);化合物X为_________(只写一种),Na2O2的作用是___________________.
27.答案(15分)
(1)4NH3+5O2 4NO+6H2O
4NO+6H2O
(2)放热
(3)浓H2SO4;生成的NO与O2反应生成NO2,NO2与水反应生成HNO3,NH3与HNO3反应生成了
(4)I;  与HCL反应生成氧气(合理答案均给分)
与HCL反应生成氧气(合理答案均给分)
[解析]本题考查氨的催化氧化。(1) 和
和 氧化生成
氧化生成 。(2)该反应为放热,故不加热后仍能保持红热状态。(3)产物中有
。(2)该反应为放热,故不加热后仍能保持红热状态。(3)产物中有 和
和 ,
, 会被
会被 氧化生成
氧化生成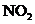 ,在于空气中的水蒸气反应生成
,在于空气中的水蒸气反应生成 ,而
,而 与
与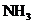 会产生白烟。(4)装置5与1均产生科产生
会产生白烟。(4)装置5与1均产生科产生 。
。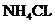 加热分解可得
加热分解可得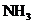 和HCL,而HCL与
和HCL,而HCL与 可生成
可生成 。
。
12.(2010全国卷1)一定条件下磷与干燥氯气反应,若0.25g磷消耗掉314mL氯气(标准状况),则产物中PCl3与PCl5的物质的量之比接近于
A.1:2 B.2:3 C.3:1 D.5:3
[解析]设n(PCl3)=X mol, n(PCl5)=Y mol,由P元素守恒有:X+Y=0.25/31≈0.008……①;由Cl元素守恒有3X+5Y=(0.314×2)/22.4≈0.028……②,联立之可解得:X=0.006,Y=0.002故选C
[命题意图]考查学生的基本化学计算能力,涉及一些方法技巧的问题,还涉及到过量问题等根据化学化学方程式的计算等
[点评]本题是个原题,用百度一搜就知道!做过多遍,用的方法很多,上面是最常见的据元素守恒来解方程法,还有十字交叉法,平均值法、得失电子守恒等多种方法,此题不好!
 (2010上海卷)31.白磷(P4)是磷的单质之一,易氧化,与卤素单质反应生成卤化磷。卤化磷通常有三卤化磷或五卤化磷,五卤化磷分子结构(以PCl5为例)如右图所示。该结构中氯原子有两种不同位置。
(2010上海卷)31.白磷(P4)是磷的单质之一,易氧化,与卤素单质反应生成卤化磷。卤化磷通常有三卤化磷或五卤化磷,五卤化磷分子结构(以PCl5为例)如右图所示。该结构中氯原子有两种不同位置。
1)6.20g白磷在足量氧气中完全燃烧生成氧化物,反应所消耗的氧气在标准状况下的体积为 L。
上述燃烧产物溶于水配成50.0mL磷酸(H3PO4)溶液,该磷酸溶液的物质的量浓度为 mol·L-1。
2)含0.300mol H3PO4的水溶液滴加到含0.500mol Ca(OH)2的悬浮液中,反应恰好完全,生成l种难溶盐和16.2g H2O。该难溶盐的化学式可表示为 。
3)白磷和氯、溴反应,生成混合卤化磷 (
(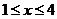 ,且x为整数)。
,且x为整数)。
如果某混合卤化磷共有3种不同结构(分子中溴原子位置不完全相同的结构),该混合卤化磷的相对分子质量为 。
4)磷腈化合物含有3种元素,且分子中原子总数小于20。0.10mol PCl5和0.10mol NH4Cl恰好完全反应,生成氯化氢和0.030mol磷腈化合物。推算磷腈化合物的相对分子质量(提示:M>300)。
答案:1)5.6;4.00;2)Ca5(PO4)3(OH);3)297.5或342;4)348或464。
解析:此题考查了元素化合物、化学计算知识。1)白磷燃烧生成五氧化二磷,白磷的相对分子质量为:128,则其6.20g的物质的量为:0.05mol,其完全燃烧消耗氧气0.25mol,标准状况下体积为5.6L;将这些白磷和水反应生成磷酸0.20mol,溶液体积为50mL,也就是0.05L,则磷酸溶液的物质的量浓度为4.00mol/L;2)根据该水溶液中含有溶质的物质的量和氢氧化钙悬浊液中溶质的物质的量,根据质量守恒,可知该物质中含有5个钙离子和3个磷酸根离子,结合电荷守恒,必还含有1个氢氧根离子,写作:Ca5(PO4)3(OH);3)根据题意x为整数,其可能为:PCl4Br、PCl3Br2、PCl2Br3、PClBr4四种,要是有三种不同结构的话,结合PCl5的结构,其可能为:PCl3Br2或PCl2Br3,则其相对分子质量可能为:297.5或342;4)根据题意和质量守恒定律,可求出化合物提供的Cl原子的物质的量为:0.1mol×5+0.1mol×1=0.6mol;由于磷腈化合物中只含有三种元素,故必须将其中的氢原子全部除去;两物质提供的H原子的物质的量为:0.1mol×4=0.4mol,则生成的氯化氢的物质的量为:0.1mol×4=0.4mol;则磷腈化合物中含有的Cl原子为:0.2mol、P原子为:0.1mol、N原子为:0.1mol,则该化合物的最简式为:PNCl2;假设其分子式为(PNCl2)x,由其含有的碳原子总数小于20,则知:4x<20,故x<5;假设x=4,其分子式为: P4N4Cl8,相对分子质量为464;假设x=3,其分子式为: P3N3Cl6,相对分子质量为:348;假设x=2,其分子式为:P2N2Cl4,相对分子质量<300 舍去。故其相对分子质量可能为:348或464。
2010年高考题
10.(2010安徽卷)低脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH2(g)+NO(g)+NH2(g) 2H3(g)+3H2O(g)
2H3(g)+3H2O(g)  H<0
H<0
在恒容的密闭容器中,下列有关说法正确的是
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
答案:C
解析:A选项,放热反应升温平衡常数减小,错误;增大一个反应物浓度另一反应物转化率增大,B错;使用催化剂平衡不移动,D错。
12.(10分)检测一个最大阻值为5 Ω的滑动变阻器,可供使用的器材如下:
A.待测滑动变阻器Rx,全电阻约为5 Ω(电阻丝绕制紧密,匝数清晰可数)
B.电流表 (量程为0.6 A,内阻约为0.6 Ω);
(量程为0.6 A,内阻约为0.6 Ω);
C.电流表 (量程为3 A,内阻约为0.12 Ω);
(量程为3 A,内阻约为0.12 Ω);
D.电压表 (量程为15 V,内阻约为15
kΩ);
(量程为15 V,内阻约为15
kΩ);
E.电压表 (量程为3 V,内阻约为3
kΩ);
(量程为3 V,内阻约为3
kΩ);
F.滑动变阻器R(最大阻值为20 Ω);
G.直流电源E(电动势为3 V,内阻不计);
H.游标卡尺;
I.毫米刻度尺;
 J.开关S、导线若干.
J.开关S、导线若干.
(1)用伏安法测定Rx的最大阻值,所选电流表为 (填“ ”或“
”或“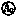 ”),所选电压表为 (填“
”),所选电压表为 (填“ ”或“
”或“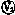 ”).
”).
(2)在虚线框中画出测量电路的原理图,并根据所画原理图将图甲中的实物连接成测量电路.
(3)为了进一步测量待测滑动变阻器电阻丝的电阻率,需要测量电阻丝的直径和总长度,在不破坏变阻器的前提下,请设计一个实验方案,写出所需器材及操作步骤,并给出直径和总长度的表达式.[2007年高考·山东理综卷]
解析:(1)电源的电动势为3 V,故电压表应选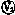 .若在待测滑动变阻器Rx两端加上3 V的电压,通过Rx的电流也仅约为0.6 A(I== A=0.6 A),故电流表应选
.若在待测滑动变阻器Rx两端加上3 V的电压,通过Rx的电流也仅约为0.6 A(I== A=0.6 A),故电流表应选 .
.
 (2)设计此题中的测量电路时,根据题中提供的可使用器材,要注意考虑两个方面的问题:①用伏安法测电阻时,电流表内外接法的选择;②将滑动变阻器接入电路时,分压式和限流式接法的选择.由于选用的电压表
(2)设计此题中的测量电路时,根据题中提供的可使用器材,要注意考虑两个方面的问题:①用伏安法测电阻时,电流表内外接法的选择;②将滑动变阻器接入电路时,分压式和限流式接法的选择.由于选用的电压表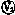 的内阻(约为3
kΩ)远大于待测滑动变阻器Rx的阻值(最大阻值为5
Ω),故采用电流表外接法.由于滑动变阻器的全电阻约为20 Ω,在此题中,采用分压式或限流式接法均能满足要求完成实验,故有两种方案可供选用.(答题时选用任一种均可)
的内阻(约为3
kΩ)远大于待测滑动变阻器Rx的阻值(最大阻值为5
Ω),故采用电流表外接法.由于滑动变阻器的全电阻约为20 Ω,在此题中,采用分压式或限流式接法均能满足要求完成实验,故有两种方案可供选用.(答题时选用任一种均可)
答案:(1)
方案一 (2)电路原理图和对应的实物连接图如图乙所示
(3)需要的器材:游标卡尺、毫米刻度尺
主要操作步骤如下:
①数出变阻器线圈缠绕的匝数n;
②用毫米刻度尺(也可以用游标卡尺)测量所有线圈的排列长度l,可得电阻丝的直径d=;
 ③用游标卡尺测量变阻器线圈部分的外径D,可得电阻丝的总长度L=nπ(D-),也可以用游标卡尺测量变阻器瓷管部分的外径D,得电阻丝的总长度L=nπ(D+);
③用游标卡尺测量变阻器线圈部分的外径D,可得电阻丝的总长度L=nπ(D-),也可以用游标卡尺测量变阻器瓷管部分的外径D,得电阻丝的总长度L=nπ(D+);
④重复测量三次,求出电阻丝的直径和总长度的平均值.
方案二 (2)电路原理图和对应的实物连接图如图丙所示
(3)需要的器材:游标卡尺.
主要操作步骤如下:
 ①数出变阻器线圈缠绕的匝数n;
①数出变阻器线圈缠绕的匝数n;
②用游标卡尺测量变阻器线圈部分的外径D1和瓷管部分的外径D2,可得电阻丝的直径d=,电阻丝的总长度L=π(D1-D2);
③重复测量三次,求出电阻丝的直径和总长度的平均值.
11.(10分)有一根细而均匀的导电材料样品,截面为同心圆环,如图甲所示.此样品的长L约为3 cm,电阻约为100 Ω,已知这种材料的电阻率为ρ,且该样品的内径太小而无法直接测量.现提供以下实验器材:
 A.20等分刻度的游标卡尺;
A.20等分刻度的游标卡尺;
B.螺旋测微器;
C.电流表 (量程为50 mA,内阻r1=100 Ω);
(量程为50 mA,内阻r1=100 Ω);
D.电流表 (量程为100 mA,内阻r2约为40 Ω);
(量程为100 mA,内阻r2约为40 Ω);
E.滑动变阻器R1(0-10 Ω,额定电流为2 A);
F.直流电源E(电动势为12 V,内阻很小);
G.导电材料样品R2(长L约为3 cm,电阻R2约为100 Ω);
H.开关一只,导线若干.
请根据上述器材设计一个尽可能精确地测量该样品内径d的实验方案,回答下列问题:
(1)用游标卡尺测得该样品的长度如图乙所示,其示数L= mm;用螺旋测微器测得该样品的外径如图丙所示,其示数D= mm.

(2)在虚线框中画出设计的实验电路图,并标明所选器材的字母.
(3)用已知物理量和所测得的物理量的符号表示样品的内径d(写出推导过程).
答案:(1)30.35 3.204-3.206
 (2)电路如图丁所示
(2)电路如图丁所示
(3)设电流表 、
、 的示数分别为I1、I2,则:
的示数分别为I1、I2,则:
I1r1=(I2-I1)R2
根据电阻定律R2=ρ,由几何知识得:
S=
联立解得:d=.
10.(10分)要测量一长度为L、直径为D的电阻丝的阻值.
(1)用多用电表粗测该段电阻丝的阻值.用已经调零且选择旋钮指向欧姆挡“×10”位置的多用电表测量,发现指针偏转角度太大,这时应将选择旋钮指向欧姆挡“ ”位置;调零后测量,其表盘及指针所指位置如图所示,则此段电阻丝的电阻为 Ω.

(2)现在需要进一步精确测量该电阻丝的阻值.实验室备有下列器材:
A.量程为0.6 A、内阻为0.5 Ω的电流表;
B.量程为3 A、内阻为0.1 Ω的电流表;
C.量程为3 V、内阻为6 kΩ的电压表;
D.量程为15 V、内阻为30 kΩ的电压表;
E.阻值范围为1 kΩ的滑动变阻器R1;
F.阻值范围为50 Ω的滑动变阻器R2;
G.蓄电池的电动势为6 V,内阻很小;
H.开关一个,导线若干.
为使测量结果尽可能准确,电流表应选用 ,电压表应选用 ,滑动变阻器应选用 .(填仪器的代号)
若选择了最合适的器材,采用最恰当的实验电路进行实验测量,电流表的示数是I,电压表的示数是U,则该电阻丝的电阻率ρ= .
解析:(1)指针偏转角度太大,说明电阻值小,这时应使选择旋钮指向较小倍率,即欧姆挡的“×1”位置,多用电表欧姆挡的示数是表针示数乘以旋钮所在位置的倍率,所以电阻值为22×1 Ω=22 Ω.
(2)测量电路中的最大电流约为I==A<0.3 A,所以电流表应选择A,电压表应选择C,滑动变阻器应选择F.
由R=和R=ρ=ρ
联立解得:ρ=.
答案:(1)×1 22 (2)A C F
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com