
9.(’08重庆理综26)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是 。
(2)一定温度下,在恒容密闭容器中N2 O5可发生下列反应:
 2N2O5(g) 4NO2(g)+O2(g);ΔH>0
2N2O5(g) 4NO2(g)+O2(g);ΔH>0
①反应达平衡后,若再通入一定量氮气,则N2O5的转化率将 。(填“增大”或“减小”、“不变”)
②下表为反应在T1温度下的部分实验数据:
|
t/s |
0 |
500 |
1000 |
|
c(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500s内N2O5的分解速率为 。
 ③在T3温度下,反应1 000 s时测得NO2的浓度为4.98 mol·L-1,则T2
T1。
③在T3温度下,反应1 000 s时测得NO2的浓度为4.98 mol·L-1,则T2
T1。
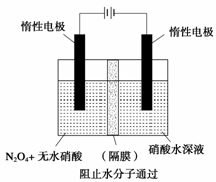
(3)如上图所示装置可用于制备N2O5,则N2O5在电解池的 区生成,其电极反应式为 .
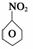 答案 (1)
答案 (1)
(2)①不变
②0.002 96 mol·L-1·s-1
③<或小于
(3)阳极 N2O4+2HNO3-2e-=2N2O5+2H+
解析 (2)①因为恒容下充入N2,N2为非反应性气体,所以平衡不移动,因而N2O5的转化率不变。
②v(N2O5)=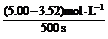
=0.002 96 mol·L-1·s-1。
③T1温度下c (NO2)求算:
 2N2O5(g) 4NO2(g)+O2(g);ΔH>0
2N2O5(g) 4NO2(g)+O2(g);ΔH>0
2 4
1 000 s时,5.00-2.48 c(NO2)
c(NO2)=2×(5.00-2.48) mol·L-1=5.04 mol·L-1>4.98 mol·L-1,由于反应是吸热反应,故温度越高NO2的浓度越大,所以得到T2<T1。
(3)由图中给定两极物质可以判断N2O5必是由N2O4氧化生成,所以N2O5在阳极产生。据电极反应离子放电顺序可知:阴极发生2H++2e-→H2↑的反应,则阳极为N2O4+2HNO3-2e- →2N2O5+2H+。
8.(’08全国Ⅱ26)红磷红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。
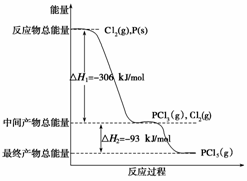
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是 。
(2)PCl5分解成PCl3和Cl2的热化学方程式是 。
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加入0.80 mol PCl5,反应达到平衡时PCl5还剩0.60 mol,其分解率α1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2 α1(填“大于”、“小于”或“等于)。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是 。
(4)P和Cl2分两步反应生成1 mol PCl5的ΔH3= ,P和Cl2一步反应生成1 mol PCl5的ΔH4 ΔH3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是 。
 答案 (1)
答案 (1)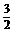 Cl2(g)+P(s) PCl3(g);ΔH=-306
kJ/mol
Cl2(g)+P(s) PCl3(g);ΔH=-306
kJ/mol
 (2)PCl5(g) PCl3(g)+Cl2(g);ΔH=93
kJ/mol 25% 大于
(2)PCl5(g) PCl3(g)+Cl2(g);ΔH=93
kJ/mol 25% 大于
(3)两步反应均为放热反应,降温有利于提高产率,防止产物分解
(4)-399 kJ/mol 等于
 (5)PCl5+4H2O H3PO4+5HCl
(5)PCl5+4H2O H3PO4+5HCl
解析 (1)产物的总能量减去反应物的总能量就等于反应热,结合图象可知,PCl3和反应物P和
 Cl2的能量差值为306 kJ,因此该热化学反应方程式为:P(s)+
Cl2的能量差值为306 kJ,因此该热化学反应方程式为:P(s)+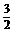 Cl2(g) PCl3(g);
Cl2(g) PCl3(g);
ΔH=-306 kJ/mol。
 (2)根据图象可知PCl5和PCl3之间的能量差值为:93 kJ,因此PCl5分解成PCl3和Cl2的热化学方程式为:PCl5(g) PCl3(g)+Cl2(g)
ΔH=93 kJ/mol,加入0.80 mol PCl5,剩余0.60
(2)根据图象可知PCl5和PCl3之间的能量差值为:93 kJ,因此PCl5分解成PCl3和Cl2的热化学方程式为:PCl5(g) PCl3(g)+Cl2(g)
ΔH=93 kJ/mol,加入0.80 mol PCl5,剩余0.60
mol,因此PCl5的分解率为: ×100%=25%,由于该反应ΔH>0即为吸热反应,因此升高温度,平衡右移,故α2>α1。
×100%=25%,由于该反应ΔH>0即为吸热反应,因此升高温度,平衡右移,故α2>α1。
(3)由于两个反应都是放热反应,降低温度有利于平衡右移,提高产率。同时由于PCl5受热易分解,因此温度低防止其分解。
(4)根据盖斯定律求得:ΔH3=-399 kJ/mol。且ΔH3=ΔH4,与反应的途径无关,只与起始物质、终了物质有关。
(5)PCl5和水发生反应,生成两种酸只能是H3PO4和HCl,其化学方程式是:
 PCl5+4H2O H3PO4+5HCl
PCl5+4H2O H3PO4+5HCl
0.40 mol·L-1c(N2)=(0.60-0.40) mol÷2.0 L=0.10 mol·L-1
c(H2)=(1.60-3×0.40) mol÷2.0 L=0.20 mol·L-1
K=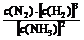 =[(0.10 mol·L-1?)×(0.20 mol·L-1)3]÷(0.40 mol·L-1)2
=[(0.10 mol·L-1?)×(0.20 mol·L-1)3]÷(0.40 mol·L-1)2
=5.0×10-3mol2·L-2
0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为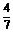 。计算:
。计算:
①该条件下N2的平衡转化率;
 ②该条件下反应2NH3(g) N2(g)+3H2(g)的平衡常数。
②该条件下反应2NH3(g) N2(g)+3H2(g)的平衡常数。
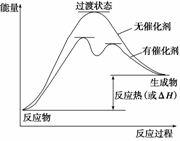 答案 (1)
答案 (1)
(2)升温、增大N2浓度、不断移出生成物
(3)①66.7% ②5.0×10-3mol2·L-2
解析 (1)催化剂能降低反应的活化能,改变反应的历程,使一个高能变过程变为几个能量相对低的过程,使反应易发生。要点是有催化剂时能量低而过程阶段多了。图见答案。
(2)加快反应速率且增大NH3生成量的方法是升温、增大N2浓度、不断移出生成物。
(3)解:①设反应过程消耗xmolN2(g)。
 N2(g)+3H2(g) 2NH3(g)
N2(g)+3H2(g) 2NH3(g)
起始物质的量/mol 0.60 1.60 0
平衡物质的量/mol 0.60-x 1.60-3x 2x
平衡时反应体系总物质的量=[(0.60-x)+(1.60-3x)+2x]mol=(2.20-2x) mol
NH3(g)的物质的量分数=2x÷(2.20-2x)=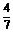
x=0.40
N2的平衡转化率=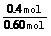 ×100%=66.7%
×100%=66.7%
 ②设反应2NH3(g)
N2(g)+3H2(g)的平衡常数为K。平衡时,c(NH3)=2×0.40 mol÷2.0 L=
②设反应2NH3(g)
N2(g)+3H2(g)的平衡常数为K。平衡时,c(NH3)=2×0.40 mol÷2.0 L=
7.(’08广东24)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105 Pa、反应时间3 h):
|
T/K |
303 |
313 |
323 |
353 |
|
NH3生成量/(10-6
mol) |
4.8 |
5.9 |
6.0 |
2.0 |
相应的热化学方程式如下:
 N2(g)+3H2O(l) 2NH3(g)+
N2(g)+3H2O(l) 2NH3(g)+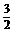 O2(g)
O2(g)
ΔH=+765.2 kJ·mol-1
回答下列问题:
(1)请画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议: 。
 (3)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。设在容积为2.0 L的密闭容器中充入
(3)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。设在容积为2.0 L的密闭容器中充入
6.(’08北京理综27)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核。通常状况下,W为无色液体。
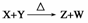 已知:
已知:
(1)Y的电子式是 。
(2)液态Z与W的电离相似,都可电离出电子数相同的两种离子,
液态Z的电离方程式是 。
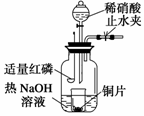
(3)用图示装置制备NO并验证其还原性。有下列主要操作:
a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中。
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸。
①步骤c后还缺少的一步主要操作是 。
②红磷充分燃烧的产物与NaOH溶液反应的离子方程式是: 。
③步骤c滴入稀硝酸后烧杯中的现象是 。反应的离子方程式是 。
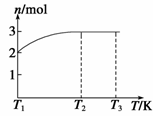 (4)一定温度下,将1 mol N2O4置于密闭容器中,保持压强不变,升高
(4)一定温度下,将1 mol N2O4置于密闭容器中,保持压强不变,升高
温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到
T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红
棕色。气体的物质的量n随温度T变化的关系如图所示。
①温度在T1-T2之间,反应的化学方程式是 。
②温度在T2-T3之间,气体的平均相对分子质量是(保留1位小数) 。
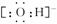 答案 (1)
答案 (1)
 (2)2NH3(l) NH-2+NH+4
(2)2NH3(l) NH-2+NH+4
(3)①打开止水夹,通入少量氧气
②P2O5+6OH-=2PO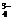 +3H2O
+3H2O
③Cu片逐渐溶解,有无色气泡产生,溶液由无色变为蓝色
 3Cu+8H++2NO
3Cu+8H++2NO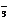 3Cu2++2NO↑+4H2O
3Cu2++2NO↑+4H2O
 (4)①2NO2
2NO+O2
(4)①2NO2
2NO+O2
②30.7
 解析 由题目中X有5个原子核,W为无色液体(H2O)且发生了X+Y
Z+W的反应可知X为NH
解析 由题目中X有5个原子核,W为无色液体(H2O)且发生了X+Y
Z+W的反应可知X为NH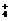 ,Y为OH-,Z为NH3,W为H2O。
,Y为OH-,Z为NH3,W为H2O。
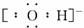 (1)OH-电子式为
。
(1)OH-电子式为
。
 (2)2NH3(1) NH
(2)2NH3(1) NH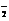 +NH
+NH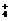
(3)①因实验目的中要求验证NO的还原性,而a、b、c三个步骤只是制NO并没有完成该目的,故应该打开止水夹,通入少量空气看是否产生红棕色气体。
②因为适量红磷、热NaOH溶液过量,则反应产物为Na3PO4。可以先写化学方程式:
 P2O5+3H2O 2H3PO4 ①
P2O5+3H2O 2H3PO4 ①
 H3PO4+3NaOH Na3PO4+3H2O ②
H3PO4+3NaOH Na3PO4+3H2O ②
 合写可得:P2O5+6NaOH 2Na3PO4+3H2O
合写可得:P2O5+6NaOH 2Na3PO4+3H2O
③气、液、固的三方向变化要答全。
 3Cu+8H++2NNO3-
3Cu2++2NO↑+4H2O
3Cu+8H++2NNO3-
3Cu2++2NO↑+4H2O
 (4)①据题图分析:T1时气体的物质的量为2 mol,则必定是NO22 mol,T2时刻气体的物质的量变为了3 mol,据所学知识只可能发生2NO2 2NO+O2的反应。
(4)①据题图分析:T1时气体的物质的量为2 mol,则必定是NO22 mol,T2时刻气体的物质的量变为了3 mol,据所学知识只可能发生2NO2 2NO+O2的反应。
②T2-T3之间无论反应与否,质量为1 mol N2O4的质量为92 g,物质的量为3 mol,则平均摩尔质量为M=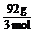 =30.7 g·mol-1,故平均相对分子质量为30.7。
=30.7 g·mol-1,故平均相对分子质量为30.7。
5.(’04广东2)上世纪80年代后期人们逐渐认识到,NO在人体内起着多方面的重要生理作用。下列关于NO的说法不正确的是 ( )
A.NO分子中有极性共价键
B.NO是造成光化学烟雾的因素之一
C.NO是汽车尾气的有害成分之一
D.NO分子所含电子总数为偶数
答案 D
解析 NO是由非金属元素氮和氧通过极性共价键而形成的极性分子,NO是造成光化学烟雾的因素之一,它主要来源于煤和石油产品的燃烧、汽车尾气及HNO3工厂废气等。1个NO分子所含电子的总数为7+8=15,故D选项不正确。
4.(’05上海3)据报道,科学家已成功合成了少量N4,有关N4的说法正确的是 ( )
A.N4是N2的同素异形体
B.N4是N2的同分异构体
C.相同质量的N4和N2所含原子个数比为1∶2
D.N4的摩尔质量是56 g
答案 A
解析 本题是“同素异形体”、“同分异构体”等基本概念的考查,以及“摩尔质量”单位及其有关计算的考查,是考生应掌握的基础知识。A项考查“同素异形体”概念:同种元素形成的不同单质之间的互称,N4和N2都是氮元素形成的单质,故A正确;B项中N4和N2很显然组成分子的原子的个数不同,故不可能是“同分子式”;C项中相同质量的N4和N2中所含原子个数比应是:总质量除以氮原子的摩尔质量之比,因总质量相同、摩尔质量相同,故应是1∶1;D项中摩尔质量的单位应是g·mol-1;故选A。
3.(’06上海16)将相同质量的铜片分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是 ( )
A.反应速率,两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
答案 B
 解析 铜片与浓、稀HNO3的反应方程式分别为Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O,
解析 铜片与浓、稀HNO3的反应方程式分别为Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O,
 3Cu+8HNO3(稀) 3Cu(NO3)2+2NO↑+4H2O,因浓度越大反应速率越大,所以A错;又因NO2为红棕色,NO为无色,所以C错;因两种酸都过量,铜完全溶解,所以转移电子数相等,D错;由方程式不难看出,同质量的铜消耗浓HNO3多,故选B。
3Cu+8HNO3(稀) 3Cu(NO3)2+2NO↑+4H2O,因浓度越大反应速率越大,所以A错;又因NO2为红棕色,NO为无色,所以C错;因两种酸都过量,铜完全溶解,所以转移电子数相等,D错;由方程式不难看出,同质量的铜消耗浓HNO3多,故选B。
2.(’07上海理综10)将空气中氮气转化成氮的化合物的过程称为固氮。下图中能实现人工固氮的是
( )

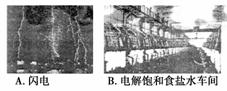
答案 D
解析 人工合成氨利用了空气中的N2,所以能实现人工固氮的是D。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com