
2.(贵州省凯里一中2010届高三第十模)取四等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:
2NO2(g) N2O4(g);△H<0
N2O4(g);△H<0
在相同反应时间间隔内,分别测定不同容器中NO2的百分含量(NO2%)并作出其随反应温度(T)变化的关系图,下列示意图中,可能与实验结果相符的是

答案 B
25 ℃时,在20 mL的盐酸中,逐滴加入0.2 mol·L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法正确的是
A.滴加前盐酸的物质的量浓度为0.1 mol·L-1
|
时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(NO2) |
0.00 |
0.48 |
b |
1.04 |
1.2 |
1.2 |
|
n(N2O4) |
0.80 |
a |
0.40 |
c |
d |
e |

B.B点的横坐标a=10
C.A、B间的任一点,溶液都有c(Cl-)>c(NH4+)> c (H+)> c(OH-)
D.如果将氨水换为NaOH溶液,则滴加20mL时溶液的pH一定小于C点的pH
答案 A
1.(2010上海市十三校高三下学期联考) 和
和 是大气的污染物,可用
是大气的污染物,可用 潮溶液吸收,反应式:
潮溶液吸收,反应式:


现有a升 (其中还含有20%的
(其中还含有20%的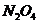 )和b升
)和b升 的混合气体,被200ml
的混合气体,被200ml 溶液完全吸收,则a/b的值可能是(气体体积均已经折算为标准状况下)
溶液完全吸收,则a/b的值可能是(气体体积均已经折算为标准状况下)
A.0.75 B.0.85 C.0.8 D.1
答案 BD
2010年联考题
题组一
22.4 L m
m=48 g
(2)根据Na2CO3质量守恒有:
1000 g×21.2%=m(Na2CO3·10H2O)·

m(Na2CO3·10H2O)=572 g
 (3)①2NO2+Na2CO3 NaNO2+NaNO3+CO2 Δm=48 g
(3)①2NO2+Na2CO3 NaNO2+NaNO3+CO2 Δm=48 g
 NO+NO2+Na2CO3 2NaNO2+CO2
NO+NO2+Na2CO3 2NaNO2+CO2
Δm=32 g
设由NO2与纯碱反应产生的CO2的物质的量为a,由NO和NO2与纯碱反应产生的CO2的物质的量为b

a=0.75 mol b=0.25 mol
n(NaNO2)∶n(NaNO3)=5∶3
②设生成的NaNO2的物质的量为5x,NaNO3的物质的量为3x,据Na+守恒:5x+3x= ×2,解得
×2,解得
x=0.5 mol。
m(NaNO2)=172.5 g,
m(H2O)=1 000 g×78.8%-688 g=100 g
析出:m(最大)(NaNO2)=172.5 g-71.2 g=101.3 g
101.(3)5∶3
(4)3
解析 本题是考察学生综合计算能力的考查题,既有根据化学方程式的计算内容,又有质量分数和有关溶解度的计算内容;既考查了学生的计算能力,又考查了学生的计算方法,是一道典型的综合计算题。
(1)根据化学反应方程式①用差量法计算:
 2NO2+Na2CO3 NaNO2+NaNO3+CO2 Δm
2NO2+Na2CO3 NaNO2+NaNO3+CO2 Δm
106 g 69g 85g 22.4 L 48 g
14.(’05上海31)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
 2NO2+Na2CO3 NaNO2+NaNO3+CO2 ①
2NO2+Na2CO3 NaNO2+NaNO3+CO2 ①
 NO+NO2+Na2CO3 2NaNO2+CO2 ②
NO+NO2+Na2CO3 2NaNO2+CO2 ②
(1)根据反应①,每产生22.4 L(标准状况下)CO2,吸收液质量将增加 g。
(2)配制1 000 g质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2O 克?
(3)现有1 000 g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4 L(标准状况)CO2时,吸收液质量就增加44 g。
①计算吸收液中NaNO2和NaNO3物质的量之比。
②1 000 g质量分数为21.2%的纯碱在20℃经充分吸收硝酸工业尾气后,蒸发掉688 g水,冷却到0℃,最多可析出NaNO2多少克?(0℃时,NaNO2的溶解度为71.2 g/100 g水)
答案 (1)48 (2)572
13.(’05天津理综29)磷在氧气中燃烧,可能生成两种固态氧化物。3.1 g的单质磷(P)在3.2 g
的氧气中燃烧,至反应物耗尽,并放出X kJ热量。
(1)通过计算确定反应产物的组成(用化学式表示)是 ,其相应的质量(g)为 。
(2)已知单质磷的燃烧热为Y kJ·mol-1,则1 mol P与O2反应生成固态P2O3的反应热ΔH= 。
(3)写出1 mol P与O2反应生成固态P2O3的热化学方程式: 。
答案 (1)P2O3、P2O5 2.75、3.55
(2)-(20X-Y)kJ·mol-1
 (3)P(s)+
(3)P(s)+ O2(g)
O2(g)  P2O3(s)
P2O3(s)
ΔH=-(20X-Y) kJ·mol-1
12. (’06上海31)已知:
(’06上海31)已知:
 4NO+3O2+2H2O 4HNO3
4NO+3O2+2H2O 4HNO3
设空气中氧气的体积分数为0.20,氮气的体积分数为0.80,请完成下列填空及计算:
(1)a mol NO完全转化为HNO3需要氧气 mol。
(2)为使NH3恰好完全氧化为一氧化氮,氨与空气混合物中氨的体积分数为 (保留
2位小数)。
(3)20.0 mol的NH3用空气氧化,产生混合物的组成为NO 18.0 mol、O2 12.0 mol、N2 150.0 mol和一定量的硝酸,以及其他成分。(高温下NO和O2不反应)
计算氨转化为NO和HNO3的转化率。
(4)20.0 mol的NH3和一定量空气充分反应后,再转化为HNO3。
①在下图中画出HNO3的物质的量n(A)和空气的物质的量n(B)关系的理论曲线。
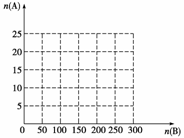
②写出当125≤n(B)≤200时,n(A)和n(B)的关系式 。
答案 (1)0.75a (2)0.14 (3)97.5%
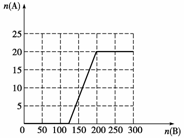 (4)①
(4)①
②n(A)=
解析 (3)设生成HNO3的物质的量为x。则
4(2x+18.0 mol× +12.0 mol)=150.0 mol
+12.0 mol)=150.0 mol
解得x=1.5 mol
NH3的转化率= ×100%=97.5%
×100%=97.5%
11. (’06江苏21)稀薄燃烧是指汽油在较大空气/燃比(空气与燃油
(’06江苏21)稀薄燃烧是指汽油在较大空气/燃比(空气与燃油
气的体积比)条件下的燃烧。随着全球能源危机的加剧,稀薄燃烧技
术的研究受到了人们的重视,但稀薄燃烧时,常用的汽车尾气净化装
置不能有效地将NOx转化为N2。不同空/燃比时汽车尾气中主要污染物
的含量变化如图所示。
(1)稀薄燃烧技术除能节约能源外,还具有的优点是 (填一项)。排放到大气中的NOx会导致酸雨、 等环境问题(填一项)。
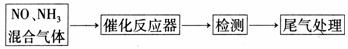 (2)某校化学研究性学习小组的同学在技术人员的指导下,按下列流程探究不同催化剂对NH3还原NO反应的催化性能。
(2)某校化学研究性学习小组的同学在技术人员的指导下,按下列流程探究不同催化剂对NH3还原NO反应的催化性能。
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通入滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。为比较不同催化剂的催化性能,需要测量并记录的数据是 。
(3)若某一催化剂能同时催化NH3等还原性气体与NOx的反应。将该催化剂分别用于催化还原含等物质的量NOx的两种气体:①纯NO气体,②汽车尾气。消耗NH3的物质的量较多的可能是 (填字母),原因是 。
A.① B.② C.都有可能
答案 (1)减少CO和碳氢化合物的污染 光化学烟雾或破坏臭氧层
(2)溶液显色所需要的时间
(3)A 汽车尾气中含有一定量的CO和碳氢化合物,少消耗NH3或B 汽车尾气中含有一定量的NO2,多消耗NH3或C 汽车尾气中同时含有CO、碳氢化合物等还原性气体和NO2等氧化性气体,二者相对含量的不同可导致消耗NH3的增多或减少
解析 本题以燃油气燃烧过程产生污染这一社会关注问题为背景,考查了环保知识和探究催化剂性能的过程及问题分析,这是一道开放性、探究性很好的试题,侧重考查了学生的自学能力、分析探究问题的能力,要求学生平日要善于思考和分析,关注社会热点,善于运用所学知识解释和解决生活中遇到的实际问题、做到理论联系实际。
(1)因燃油气燃烧过程中可产生对空气有污染的CO、NOx、碳氢化合物等大气污染物,结合“空/燃比”的含义和题图可以推知,增大“空/燃比”可以减少CO、碳氢化合物的排放从而减少污染,根据课本知识可推出排放到大气中的NOx可导致酸雨及光化学烟雾(或破坏臭氧层)而引起环境污染。
(2)因实验的目的是探究催化剂的催化性,而从所给的探究步骤中,有滴有酚酞的稀硫酸(该溶液为无色),所以肯定是利用NH3与硫酸的酚酞溶液作用显红色的快慢来检测催化性能。只要记录显色所需时间即可。
(3)根据氧化还原反应中电子得失守恒原则可推知,若汽车尾气中会有一定量的CO和碳氢化合物,因它们也可以还原NOx,则所消耗氨气就少,若汽车尾气中含NO2,则因NO2也可氧化NH3,则消耗的氨气就多。
10.(’07江苏21)工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。请按要求回答 下列问题:
(1)将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式: 、 。
(2)在尾气与氨水反应所得到的高浓度溶液中,按一定比例加入氨水或碳酸氢铵,此时溶液的温度会自行降低,并析出晶体。①导致溶液温度降低的原因可能是 ;②析出的晶体可用于造纸工业,也可用于照相用显影液的生产。已知该结晶水合物的相对分子质量为134,则其化学式为 ;③生产中往往需要向溶液中加入适量的对苯二酚或对苯二胺等物质,其目的是 。
(3)能用于测定硫酸尾气中SO2含量的是 。(填字母)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液 D.氨水、酚酞试液
 答案 (1)2H2SO3+O2 2H2SO4
答案 (1)2H2SO3+O2 2H2SO4
 2(NH4)2SO3+O2 2(NH4)2SO4
2(NH4)2SO3+O2 2(NH4)2SO4
 2NH4HSO3+O2
2NH4HSO4(任填两个)
2NH4HSO3+O2
2NH4HSO4(任填两个)
(2)①反应吸热
②(NH4)2SO3·H2O
③防止亚硫酸铵被氧化
(3)BC
解析 (1)本题要注意题目要求的是写出两个氧化还原反应的方程式(见答案)。
(2)①溶液温度降低一定是反应吸热所致;②析出的晶体用于造纸和显影液,说明晶体中含有还原性+4价硫,因此推知晶体的主要成分为(NH4)2SO3,根据相对分子质量为134,可推出其化学式为(NH4)2SO3·H2O;③根据对苯二酚具有还原性(或+4价硫有还原性)推出加入对苯二酚和对苯二胺的目的(见答案)。
(3)要测定尾气中SO2的含量,则所选物质的反应要较唯一,且反应后现象明显,故选B、C。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com