
12.(河南省平顶山市2010年高一上学期期末调研考试)(1)金属铜在常温下与浓硝酸和稀硝酸都能发生反应,但反应的剧烈程度和部分产物不同,则金属铜与浓硝酸反应的化学方程式为: ;金属铜与稀硝酸反应的离子方程式为: 。
(2) )合成氨是人类科学技术发展史上一项重大突破,解决了地球上因粮食不足而导致的饥饿和死亡问题。氨可用于工业上制硝酸,其中的一步反应的化学方程式为:

其中还原剂是_____________(填化学式),若有68g NH3参加反应,转移电子的物质的量为______________mol。
答案(1) Cu+4HNO3=Cu(NO3)2+2H2O+2NO2↑ (2分)
3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑ (2分)
(2) NH3 (1分) 20 (2分)
11.(河南省焦作市2010年高一上学期期末考试)(1)①实验室制备氨气,下列方法中适宜选用的是 。
A.固态氯化铵加热分解
B.氢氧化钠溶液中滴加稀氨水
C.氯化铵溶液与氢氧化钠溶液共热
D.固态氯化铵与氢氧化钙混合加热
②检验氨气是否已经收集满的方法是 。 ③为了得到干燥的NH3,用________干燥剂。
A、碱石灰 B、浓H2SO4 C、无水CaCl2 D、P2O5
答案(1)①D ②湿润的红色湿润石蕊试纸或玻璃棒蘸浓盐酸靠近集气瓶口.③A
(2)①AFECDB ②丙中的品红未褪色,乙中溶液变浑浊
③C + 2H2SO4
(浓)  CO2↑+ 2SO2↑+ 2H2O
CO2↑+ 2SO2↑+ 2H2O
10.(上海市杨浦区2010届高三上学期期末学科测试)由氮气和氢气合成氨气的反应在一定条件下已达到平衡状态:
(1)若用氢气表示正反应速率(V正(H2)),氨气表示逆反应速率(V逆(NH3)),则
V正(H2):V逆(NH3) = 。
(2)若降低温度,V正 (填“增大”、“不变”、“减小”),平衡向 移动(填“正反应方向”或“逆反应方向”),若每生成1摩尔氨气放出的热量是46.2千焦,则上述反应的热化学方程式为 。
(3)若增加氢气的浓度,氮气的转化率 (填“增大”、“减小”、“不
变”);若将氨分离出来,化学平衡常数 (填“增大”、“减小”、“不变”)。
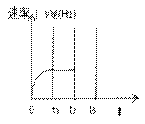 (4)右图是用H2表示的逆反应速率(V逆(H2))随反应时间的
(4)右图是用H2表示的逆反应速率(V逆(H2))随反应时间的
变化关系图象。已知t1达平衡,请在右图中画出在 t2时刻增大压强、
在t3 时刻再次达平衡的变化曲线。
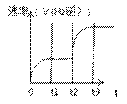 答案(1)V正(H2):V逆(NH3)=3:2(1分)
答案(1)V正(H2):V逆(NH3)=3:2(1分)
(2)减小(1分) 、正反应方向(1分)、
N2(g)+3H2(g)  2NH3(g) +92.4KJ(1分)
2NH3(g) +92.4KJ(1分)
(3)增大(1分) 不变(1分)
(4)如图(2分)
9.(河南省新乡市2010年高一上学期期末考试)
某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去)。请回答:
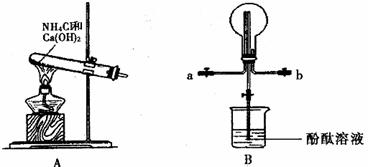
(1)实验室制备氨气的化学方程式为 。
(2)用装置B收集氨气时,应选择氨气的进气口是 (选填“a”或“b”),并说明选择的理由是: 。
(3)打开装置B中的止水夹,若观察到烧瓶内产生了红色喷泉,则说明氨气具有的性质是 , 。
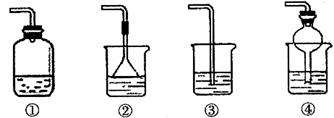
(4)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是: (填序号)。
答案
8.(上海市杨浦区2010届高三上学期期末学科测试)根据课本的介绍,下列工业生产过程中不需要使用氨水或氨气的是
A.硫酸的工业制法 B.石油的催化裂化
C.硝酸的工业制法 D.联合制碱工业
答案 B
7.(安徽省屯溪一中2010届高三上学期期中考试)X、Y、Z、W、Q 均为含氮的化合物,我们不了解它们的化学式,但知道它们在一定条件下有如下转换关系(未配平): (1) X→W + O2 ; (2) Z + Y + NaOH→H2O + W
(3) Y + SO2→Z + SO3 (4) Q + Y→Z + H2O (5) X + Cu + H2SO4(浓)→ Cu2+ + Y + SO42-
则这五种化合物中氮的化合价由高到低的顺序为 ( )
A. X Y Z W Q B. X Z Y Q W C. X Y W Z Q D. W X Z Q Y
答案 C
6.(重庆西南师大附中2010年高二上学期期末考试)关于合成氨的反应N2+3H2 2NH3,下列有关说法不正确的是( )
2NH3,下列有关说法不正确的是( )
A.选择工业反应条件时,要综合考虑反应的快慢和反应进行的程度
B.升高温度与加催化剂都能增大反应物活化分子百分率
C.根据勒夏特列原理,为了使反应正向移动,工业上选择高温高压合成氨
D.若2v(N2)正 = v(NH3)逆,则反应达平衡
答案 C
5.(贵州省清华实验学校2010届高三上学期期末考试)三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3 NF3 + 5 H2O = 2 NO + HNO3 + 9 HF。下列有关该反应的说法正确的是 ( )
A.NF3是氧化剂,H2O是还原剂
B.还原剂与氧化剂的物质的量之比为2:1
C.若生成0.2 mol HNO3,则转移0.2 mol电子
D.NF3在潮湿的空气中泄漏会产生红棕色气体
答案 D
4.(贵州省清华实验学校2010届高三上学期期末考试)相同温度下等物质的量浓度的下列溶液中,pH值最小的是 ( )
A.NH4Cl B.NH4HCO3 C.NH4HSO4 D.(NH4)2SO4
答案 C
3.(重庆西南师大附中2010年高二上学期期末考试)在 – 50℃时,液氨和水一样,是一种极性溶剂,可发生如下电离:2NH3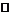 NH4+ +NH2-,两种离子的平衡浓度均为1×10-15mol/L,下列有关叙述正确的是( )
NH4+ +NH2-,两种离子的平衡浓度均为1×10-15mol/L,下列有关叙述正确的是( )
A.此温度下,液氨的离子积常数为1×10-15
B.保持温度不变,在液氨中放入NaNH2,则液氨离子积常数增大
C.保持温度不变,在液氨中加入NH4Cl固体,液氨电离程度减小,NH4+浓度增大
D.向NH4Cl的液氨溶液中,再加入一定量的溶剂液氨,各微粒浓度都减小
答案 C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com