
4.秦汉文化处于世界领先地位,其中造成“中外文化交流的频繁”这一特点的直接原因 ( )
A.封建专制主义中央集权制度得以确立与巩固
B.处在封建盛世时期,经济文化高度发达
C.中外交通发达,政府重视对外交流
D.科技文化先进,对周边国家有强大的吸引力
3.下列有关秦汉监察制度的表述不确切的是: ( )
A.秦朝御史大夫负责监察百官
B.汉初实行了一套比秦朝更为严密的监察制度
C.西汉刺史级别不高,但巡察时代表中央监察诸侯王和地方高官
D.东汉时期刺史执掌州的军政大权,失去监察官的作用
2.古人对秦朝短命而亡的主要原因的分析,最准确的是 ( )
A.废先王之道,燔百家之言,以愚黔首
B.四维(礼义廉耻)不张…故万民离叛
C.所以硷灭而降辱者,(亡于)六王之后也
D.乃举措暴众而用刑太极故也
1.秦朝建立的专制主义中央集权的本质特征是 ( )
A.改国王为皇帝 B.建立中央官制 C.实行郡县制 D.皇权至高无上
29.(10分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
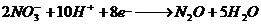
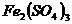 、
、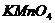 、
、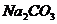 、
、
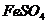 四种物质中的一种物质能使上述还原过程发生。
四种物质中的一种物质能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式: 。
(2)该反应中氧化剂和还原剂物质的量之比为 。
(3)反应中硝酸体现了 、 性质。
(4)反应中若产生0.1mol气体,则转移电子的物质的量是 mol.
贵州省银河中学2010届高三下学期3月月考
28.(10分)由中国科研人员从中药材中提取的金丝桃素对人工感染的H5N1亚型禽流感家禽活体具有100%的治愈率。根据下面金丝桃素的结构简式回答下列问题:
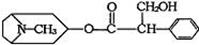
(1)金丝桃素能在NaOH水溶液中加热反应得A和B,B为芳香族化合物,写出B的结
构简式:B: ,该反应属于 反应。
(2)室温下,B用稀盐酸酸化得C,下列物质中不能和C发生反应的是 (填序号)
①浓H2SO4和HNO3的混合 ②H2(催化剂加热) ③CH3CH2CH2CH3
④Na ⑤O2(催化剂) ⑥Na2CO3溶液
(3)写出两分子C与浓H2SO4共热,生成八元环状物的化学方程式: 。
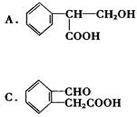
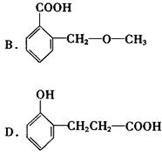
(4)下列物质与C互为同分异构体的有 。
27.(8分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
|
阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
|
阴离子 |
OH-、C1-、CO32-、NO3-、SO42- |
已知:
①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀。
试回答下列问题:
(1)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为: 。
(2)写出E溶液与过量的B溶液反应的离子方程式 。
(3)已知:NaOH(aq)+HNO3(aq)= NaNO3(aq)+H2O(1);△H=-a KJ·mol-1。请写出B与C的稀溶液反应的热化学方程式 。
(4)在100mL0.1mol·L-1E溶液中,逐滴加入35mL 2mol·L-1NaOH溶液,最终得到沉淀物质的量为 。
26.(14分)实验室有一瓶Na2SO3固体,可能含有NaCl、Na2SO4、BaCl2、K2CO3、K2SO4中的一种或几种杂质,通过下列实验确定该样品的成分及Na2SO3的质量分数。
①取少量样品于试管中,加水振荡,未见沉淀生成;
②透过蓝色钴玻璃观察,焰色反应无紫色;
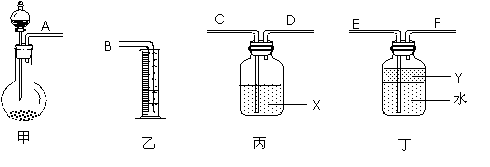 ③用下图所示仪器进行合理组装,测定产生气体的体积(SO2在硫酸中的溶解忽略不计)
③用下图所示仪器进行合理组装,测定产生气体的体积(SO2在硫酸中的溶解忽略不计)
请回答下列问题:
⑴按气流从左到右方向,正确的连接顺序为:A接___,___接____,____接B。
⑵利用所组装置,由分液漏斗向圆底烧瓶中滴加10mL水,将排入量筒中___mL液体。
⑶液体X是____________,其作用是______________________________。
⑷Y的作用是防止产生的气体溶于水,下列所给试剂符合要求的是______。
A.苯 B.四氯化碳 C.酒精 D.汽油
若称取样品3.00g,加入10.0mol/L的硫酸至过量(5mL),产生无色气体,排入量筒中液体的体积为229mL(标准状况)。
⑸对获得准确的气体体积无益的操作有_________(填序号)
①检查装置的气密性;
②连通乙、丁的导管要预先注满水;
③读数时视线与量筒内凹液面最低点相平;
④恢复到室温后再上下调整量筒位置,使乙、丁两液面相平;
⑤在甲装置胶塞上再连接一个导管,通入N2将系统中SO2全部排出。
⑹向逸出气体后的溶液中加入稍过量的BaCl2溶液,过滤、洗涤、干燥,得到白色沉淀13.98g。根据实验所得现象及数据,可知:样品中Na2SO3的质量分数是_____,含有的杂质是__________________。
25.(12分)居室是我们日常生活中最重要的场所。现代人在“煤烟型”、“光化学烟雾”污染后,正在进入以“室内空气污染”为标志的第三污染时期。造成室内环境污染的有毒物质主要有甲醛、苯、氨、氡四种。
请回答下列问题:
(1)氨分子的电子式是 ,苯分子的空间构型为 。
(2)提出减少室内空气污染的一条措施: 。
(3)我国《室内空气质量标准》规定室内空气中甲醛含量不得超过0.08mg•m-3,甲醛测定的方法主要有分光光度法、色谱法、电化学法、化学滴定法等。某校研究性学习小组的同学拟采用化学滴定法对教室内空气中甲醛的含量进行测定,如果你参与该研究课题,你采集甲醛样品的方法是 。
(4)碘量法是化学滴定法之一。碘量法原理为在碱性介质(NaOH)中,碘转化为次碘酸钠和碘化钠,次碘酸钠将溶液中游离的甲醛氧化为甲酸钠;经适当酸化后,剩余的次碘酸钠与碘化钠又生成碘;以淀粉为指示剂,用硫代硫酸钠标准溶液滴定。
上述过程中涉及的化学反应的离子方程式依次为: ①I2+2OH-====IO- + I- + H2O 、② 、③ 、④I2+2S2O32-====S4O62-+2I-。
实验过程中需要测定的数据除总碘量外,还有 。
24.(10分) 碱式氯化铜(Cupric
Chloride,不溶于水的绿色结晶)是一种农药,分子式:CuCl2·3Cu(OH)2·xH2O(x=1/2,1,2)。为验证其组成并确定X值,某学生设计了以下几步实验:
碱式氯化铜(Cupric
Chloride,不溶于水的绿色结晶)是一种农药,分子式:CuCl2·3Cu(OH)2·xH2O(x=1/2,1,2)。为验证其组成并确定X值,某学生设计了以下几步实验:
①取a g的晶体研成粉末。
②晶体在空气中加热至确认质量不再变化为止(铜仍为二价),冷却后称其质量为b g。
③另取a g的晶体,溶于足量某溶液中充分溶解得到溶液。
④向③得到的溶液中加入足量的硝酸银溶液,最后得到纯净固体称量为c g。
若以上操作均正确,试回答下列问题:
(1)以上实验中用到玻璃棒的步骤有 ____ (填序号)。
(2)步骤②中晶体应放在 _(填仪器名称)中灼烧,灼烧后得到的固体应为______ _____(填化学式)。
(3)步骤③所用的溶液可能是 ;
(4)步骤④主要包括:加入足量硝酸银溶液→ → → 晾干→称量;
(5)若组成符合通式,则可以计算x的物理量组合是 ____ (填序号)。
A.a、b B.a、c C.b、c D.a、b、c 缺一不可
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com