
3.用稀盐酸与Na2CO3还是NaHCO3制作的灭火器灭火效果好,有哪些优点?
答案:用稀盐酸与NaHCO3制作的灭火器灭火效果好.优点有二:①产生气体速度快,②产生气体CO2多.
2.万一被钠灼伤了皮肤,应该怎么办?
答案:万一被钠灼伤了皮肤,应先用稀醋酸洗涤,然后再涂上3%-5%的硼酸溶液.情况严重者速到医院烧伤科救治.
1.若钠、钾等碱金属在空气中失火,可否用水或CO2灭火,为什么?用什么灭火效果好?
答案:钠、钾等碱金属失火不能用水灭火,因为它们与水反应剧烈,且产生易燃气体H2,易导致爆炸发生;也不能用CO2灭火,因为Na、K有还原性,能夺去CO2中的氧继续燃烧.
钠、钾失火可用沙土、抹布扑灭或盖灭.
(1)实验步骤
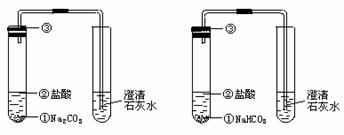
图2-10
(2)反应原理
Na2CO3+2HCl=2NaCl+H2O+CO2↑或CO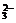 +2H+=H2O+CO2↑
+2H+=H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑或HCO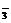 +H+H2O+CO2↑
+H+H2O+CO2↑
(3)注意事项:使用的盐酸浓度不能太大,否则生成的气泡太多太迅速而溢出试管.
(4)实验现象和结论
两者都与盐酸反应生成使澄清石灰水变浑浊的气体,但NaHCO3与盐酸反应更剧烈.
(1)实验过程
①用一干燥大试管,装入NaHCO3粉末.(大约占试管容积1/6)
②将大试管用带导气管的单孔塞塞紧.并将大试管固定在铁架台上,且试管口稍向下倾斜.
③大试管上的导气管另一端插入到盛有澄清石灰水的试管中.
④用酒精灯加热,先均匀受热,然后固定在药品多的部位加热.
⑤当试管中产生气体减少时,先把导管从澄清石灰水中拿出来,再熄灭酒精灯
(2)反应原理
2NaHCO3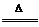 Na2CO3+H2O↑+CO2↑
Na2CO3+H2O↑+CO2↑
(3)注意事项
①装药品时,应将药品倾斜地铺在试管底部,以便于受热.
②固定大试管时,应夹在其中上部(离管口1/3处)且要使试管口略向下倾斜.防止反应生成的水冷却回流而将试管炸裂.
③当试管中产生气体减少时,若停止实验,应先将导气管从石灰水中取出来,再撤去酒精灯停止加热,否则,会使石灰水倒吸而引起试管炸裂.
(4)实验现象
澄清石灰水变浑浊,大试管内壁有水生成.
(5)实验结论
NaHCO3受热易发生分解反应.
4.钠和氧气的反应
(1)实验过程:①②③④⑤⑥⑦
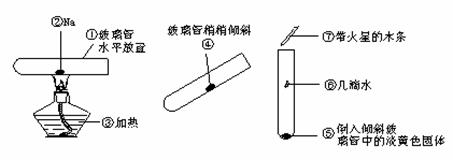
钠与氧气的反应
图2-9
(2)反应原理:2Na+O2 Na2O2,2Na2O2+2H2O=4NaOH+O2↑
Na2O2,2Na2O2+2H2O=4NaOH+O2↑
(3)注意事项
①玻璃管中装的钠不能太大,太大反应太剧烈,会将玻璃管炸裂.
②反应开始时,即钠熔成小球后要稍稍倾斜玻璃管,但是角度不能太大,以防止钠从玻璃管中脱出.并能保证空气疏通从而观察到明显现象.
③在取钠时要将其表面的氧化物用小刀除去,用纯钠进行实验.因为表面被氧化的钠在受热熔化后,钠表面会有一层黑色而影响实验现象的观察.
④加热时间不能太长,否则钠与O2迅速反应、燃烧起来,现象就不是很明显了.
⑤盛Na2O2的小试管要干燥.
(4)实验现象
钠熔成小球,先变成白色后变成淡黄色固体,淡黄色固体遇水放出使带火星木条复燃的气体.
(5)实验结论
钠熔点低,与O2加热反应生成Na2O2,Na2O2遇水生成O2.
3.收集并检验钠与水反应放出的气体
(1)实验过程:①②③④⑤
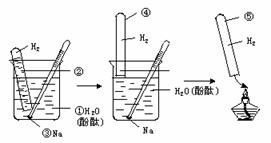
收集并检验Na与水反应生成的气体
图2-8
(2)反应原理:2Na+2H2O=2NaOH+H2↑,2H2+O2 2H2O.
2H2O.
(3)注意事项
①试管内要装满水,不要留有气泡,以防点燃时发生爆炸.
②钠不要太大,用刺有小孔的铝箔包住.包裹时不要用手触摸金属钠.
③试管中气体集满后,不要急于从水中取出试管,应待钠反应完毕后再取试管,以避免在取试管时,皮肤蘸上钠而灼伤.
④试管从取出到移近火焰过程中要始终倒立,点燃时可将试管微微倾斜.
(4)实验现象:试管内气体被点燃发出尖锐的爆鸣声.
(5)实验结论:钠与水反应剧烈,生成碱放出氢气.
2.钠与水的反应
(1)实验过程:①②③④
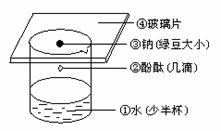
Na与水的反应
图2-7
(2)反应原理:2Na+2H2O=2NaOH+H2↑
(3)注意事项:取钠不要太大,钠块过大,会发生爆炸.
(4)实验现象:①钠与水剧烈反应、②钠熔化成小球、③钠球在水面上不停地滚动、④有气体生成,并发出嘶嘶声.
(5)实验结论:钠与水反应剧烈,生成碱并放出气体.
1.钠的物理性质
(1)实验过程
将钠用镊子从煤油中取出,用滤纸吸干煤油,然后在玻璃片上将钠用小刀切下一小块(豆粒大小),进行观察,并注意切面的变化.
(2)注意事项
①取钠时要用镊子夹取、不能用手拿,因为易与汗液反应,灼伤腐蚀皮肤.
②取出钠后要迅速吸干煤油,并要放到玻璃上切割.
③钠用剩后要放回盛钠的试剂瓶,不能乱扔乱放,因为钠很活泼容易引起危险.
④钠与O2反应很容易,在观察钠的颜色光泽时要在切割后立即观察.
(3)实验现象
切面银白色,但迅速变暗(4Na+O2=2Na2O等),失去金属光泽.
(4)实验结论
金属钠硬度很小(质软),具有银白色金属光泽,很容易被空气氧化.
4.焰色反应
这个实验是以不同的碱金属盐类呈现各自的特征焰色为基础的,为了能够便于观察,最好用无色火焰,所以用煤气灯较好,因煤气灯的火焰本身颜色较微弱,干扰较小.一般酒精灯火焰呈杂色,可向学生作适当说明,每做一次实验,都要把铂丝重新用稀盐酸和蒸馏水反复洗净,再在火焰上灼烧至无色,才可继续做实验.做焰色反应实验时,要把蘸有金属化合物溶液的铂丝放在灯焰外焰上灼烧,使形成的火焰较长,焰色反应现象比较明显.
焰色反应实验也可采用下述方法进行:
在铁丝(或玻璃棒)一端捆少量棉花,蘸些酒精,在酒精灯火焰上点燃,向燃着的棉花上滴钠盐或钾盐的溶液.
如无铂丝,可用无锈洁净的铁丝代替,也能得到较好的效果.
做焰色反应实验时,溶液的浓度大一些为好,浓度太小呈现的焰色很快消去,不易观察,做实验时,可以用铂丝蘸一些蒸馏水后再蘸一些盐的粉末,然后进行灼烧,这样效果更明显.
实验完毕,要把装在玻璃棒上的铂丝放在盐酸里浸渍2 min-3 min,再用蒸馏水洗净,保存在试管里,使它洁净无垢.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com