
15.甲、乙两位同学用一种标准盐酸去测定某一种未知浓度的NaOH溶液,但操作不同:甲把一定体积的NaOH溶液放入锥形瓶,把放入滴定管进行滴定;乙把一定体积的标准盐酸放入锥形瓶,把未知NaOH液溶液放入滴定管进行滴定。
(1)甲使用的是 滴定管,乙使用的是 滴定管;
(2)甲同学在操作中完全中和10.00ml未知浓度的NaOH溶液用去了1.00mol/L的标准盐酸20.00ml,则该未知浓度的NaOH溶液浓度值为多大?列出化学方程式并写出计算过程。
14.有一种氢氧化钠溶液,测得溶液中的c(OH-)为1×10-2,则溶液PH值为多少?
13.氨气溶于水形成的饱和溶液中存在以下平衡:
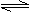
 NH3+H2O NH3•H2O NH4++OH- ⑴-⑷填“增大”、“减小”或“不变”
NH3+H2O NH3•H2O NH4++OH- ⑴-⑷填“增大”、“减小”或“不变”
(1)在氨水中滴加盐酸,平衡向 反应方向移动,c(NH4+)
(2)在氨水中加入KOH固体,平衡向 反应方向移动,c(NH4+)
(3)在氨水中加入NH4Cl固体,平衡向 反应方向移动,c(NH4+)
(4)升高温度,平衡向 反应方向移动,c(NH4+)
12.写出下列反应的化学方程式,并注明其溶液的酸碱性:
(1)CH3COOK 。 。
(2)Fe2(SO4)3 。 。
11. 写出下列物质的在水中的电离方程式:
(1)一水合氨 。
(2)硫酸氢钾 。
(3)次氯酸 。
(4)碳酸氢钠 。
10.常温下,在0.1mol/的醋酸溶液中,水的离子积是( )
A. 1×10-14 B.1×10-13 C.1.32×10-14 D.1.32×10-15
9.下列说法中正确的是( )
A.同体积同浓度的盐酸和醋酸与足量锌反应,开始时,盐酸反应速率快
B.同体积同浓度的盐酸和醋酸与足量锌反应,盐酸放出的H2多
C.PH值相同的盐酸和醋酸,两者的物质的量相同
D.盐酸和醋酸与锌反应的离子方程式完全相同
8.常温下,下列水溶液的PH值最大的是( )
A. NaHCO3 B.AlCl3 C.NaCl D.KHSO
7.要使水的电离平衡向右移动,且使pH<7,可采取的措施是( )
A.加少量NaOH B.加少量NH4Cl C.加少量盐酸 D.加热
6.在100mL0.1mol/L 的醋酸溶液中,欲使醋酸的电离程度增大,H+ 浓度减小,可采用的方法是( )
A.加热 B.加入0.1mol/L 的醋酸溶液100mL
C.加入少量的0.5mol/L的硫酸 D.加水稀释
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com