
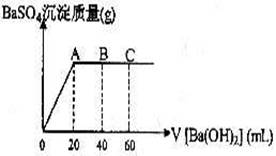
29.(8分)在t℃时,稀硫酸和盐酸混合液中,c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12.向20mL该混合酸溶液中逐滴加入pH=11Ba(OH)2溶液,生成BaSO4的量如图所示,当加入60mL Ba(OH)2溶液时,C点溶液的pH=6(体积变化忽略不计),试计算:
(1)最初混合酸溶液中c(H2SO4)= ,c(HCl)= ;
(2)A点pH= ;
(3)B点比最初混合酸的pH增加多少(写出计算过程)?(lg3=0.48)
28. (8分)(1)10mLpH=5的盐酸,稀释1000倍时,pH__________。
(2)常温下,pH=5和pH=3的盐酸溶液等体积混合后溶液的pH=_________。
(3) 某温度(t℃)时,水的KW=10-13,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,若所得混合溶液为中性,则a:b=_________;
若所得混合溶液pH=2,则a:b=__________。
27. (6分)25℃时,有0.01 mol•L-1的醋酸溶液,(1)醋酸的电离平衡常数表达式
达平衡时,溶液中氢离子浓度是 (25℃时,醋酸的电离平衡常数为1. 75×10 -5)
当向该溶液中加入一定量的盐酸时,电离常数 发生变化(填是否)
26.(13分)某工厂废水中含游离态氯,通过下列实验测定其浓度
①取水样10.0mL于锥形瓶,加入10.0 mLKI溶液(足量),滴入指示剂2-3滴。
②取一滴定管依次用自来水,蒸馏水洗净,然后注入0.01 mol·L-1的Na2S2O3溶液,调整液面,记下读数。

 ③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3 =2NaI+Na2S4O6。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3 =2NaI+Na2S4O6。
试回答下列问题:
(1)步骤①加入的指示剂是 。
(2) 取水样应使用 滴定管(填A或B)。
如果滴定管A内部有气泡,赶走气泡的操作是
(3)步聚③当待测液由 色变为 色且30s不再变化即达终点,若耗去Na2S2O3溶液20.00mL,则废水中C12的物质的量浓度为 。
(4)Cl2的实际浓度比所测浓度应 (填“偏大”、“偏小”或“相等”),造成误差的原因是 。
25. (12分) ⑴下列电解质中,①NaCl;②NaOH;③NH3·H2O;④CH3COOH;⑤BaSO4;⑥AgCl;⑦Na2O;⑧K2O;⑨H2O, ______________是弱电解质。
⑵pH相等的盐酸和醋酸,稀释后pH仍相同,则盐酸的稀释倍数 (填大、小)。
pH相等的NaOH溶液和氨水 ,加水稀释相同倍数后, pH大的是
⑶有pH均为2的盐酸、硫酸和醋酸三种溶液,
①若分别用这三种酸中和含等物质的量NaOH的溶液,所需酸溶液的体积分别为a、b、c,则它们的大小关系是 ;
②若在相同条件下产生的气体体积分别是a、b、c,则它们的大小关系是 。
③盐酸中c(Cl-)与醋酸中c(CH3COO-)的大小关系是 ,
24. (8分)①用0.1mol/L的盐酸滴定未知浓度的NaOH溶液 ,下列操作使滴定结果偏低的
是 (填序号)
(1)滴定前,在用蒸馏水洗涤滴定管后,未用标准液润洗。
(2)滴定前,滴定管尖端有气泡,滴定后气泡消失。
(3)滴定前,用待测液润洗锥形瓶。
(4)读取标准液的刻度时,滴定前平视,滴定后俯视。
(5)滴定后,滴定管尖端挂有液滴未滴入锥形瓶中。
(6)滴定过程中,锥形瓶振荡太剧烈,有少量溶液溅出。
(7)滴定过程中向锥形瓶内加入少量蒸馏水。
(8)过早估计滴定终点。
②、正确书写电离方程式
H2SO3
Cu(OH)2
NaHCO3
23. 已知下面三个数据:①7.2×10-4、②2.6×10-4、③4.9×10-10分别是三种酸的电离平衡常数,若已知这三种酸可发生如下反应:NaCN+HNO2==HCN+NaNO2
NaNO2+HF==HCN+NaF NaNO2+HF==HNO2+NaF
由此可判断下列叙述中正确的是( )
A. HF的电离常数是① B. HNO2的电离常数是①
C. HCN的电离常数是② D. HNO2的电离常数是③
卷Ⅱ(非选择题,共55分)
22.取pH均等于2的盐酸和醋酸各100mL分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是
A.醋酸与锌反应放出氢气多 B.盐酸和醋酸分别与锌反应放出的氢气一样多
C.醋酸与锌反应速率大 D.盐酸和醋分别与锌反应的速度一样大
21、在水电离出的c(H+)=1×10-12mol/L溶液中,一定不能大量共存的离子组是 ( )
A.K+、Fe2+、Cl-、NO3-
B.Ba2+、Na+、Cl-、NO3-
C.Na+、K+、HCO3-、SO42-
D.Al3+、NH4+、SO42-、Cl-
20.某温度下重水(D2O)的离子积常数为1.6×10-15,用定义pH一样来规定pD=-l g{c(D+)},则该温度下,下列叙述正确的是( )
A.纯净的重水(D2O)中,pD=7
B.1 L溶解有0.01 mol DCl的重水溶液,其pD=12.0
C.纯净的重水中,c(D+)=c(OD-)
D.1 L溶解有0.01 mol NaOD的重水溶液,其pD=12.0
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com