
2.Fe(OH)2和Fe(OH)3从溶液中析出的现象不同,前者是白色絮状沉淀,后者是红褐色沉淀。而Fe(OH)2极不稳定,易被氧化成Fe(OH)3,反应现象是:白色→灰绿色→红褐色。
若要观察到白色的Fe(OH)2沉淀,需要创造以下条件:
(1)排除亚铁盐溶液里的Fe3+离子,以免Fe3+离子直接与OH-结合生成Fe(OH)3。
(2)尽量排除溶液中溶解的氧气(绝对排除是办不到的),以减慢生成的Fe(OH)2被氧化成Fe(OH)3的速度。
反应要用新制备的亚铁盐溶液,并放入少量的铁以防止Fe3+离子产生。亚铁盐溶液与碱溶液在混合前分别加热以排除溶有的空气,然后,把碱溶液沿着试管壁加入盛亚铁盐溶液的试管中,或把滴管尖嘴直接插入液面下再加入碱溶液,可观察到白色絮状沉淀。
1. Fe3O4是复杂的化合物,经研究证明,在Fe3O4晶体中有1/3的Fe是+2价,有2/3的Fe是+3价,可看成FeO·Fe2O3,实际应写成Fe(FeO2)2,即铁酸亚铁盐,不是一般的氧化物。
2.铁的氢氧化物的比较
|
|
Fe(OH)2 |
Fe(OH)3 |
|
物理性质 |
白色,难溶于水的固体 |
红褐色,难溶于水的固体 |
|
化学性质 |
(1)与非氧化性强酸反应 Fe(OH)2+2H+=Fe2++2H2O (2)与氧化性酸反应 3Fe(OH)2+10HNO3=3Fe(NO3)3+NO↑+8H2O (3)空气中放置被氧化 4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
(1)与酸反应 Fe(OH)3+3H+=Fe3++3H2O (2)受热分解 2Fe(OH)3=Fe2O3+3H2O |
|
制备 |
①煮沸蒸馏水,赶走溶解的氧气②煮沸NaOH溶液,赶走溶解的氧气③配制FeSO4溶液,加少量的还原铁粉④用长滴管将NaOH溶液送入FeSO4溶液液面以下 Fe2++2OH-=Fe(OH)2↓ |
将NaOH溶液滴入Fe2(SO4)3溶液中 Fe3++3OH-=Fe(OH)3↓ |
1.铁的氧化物的比较
|
铁的氧 化物 |
FeO |
Fe2O3 |
Fe3O4 |
|
|
俗称 |
|
铁红 |
磁性氧化铁 |
|
|
色、态 |
黑色粉末 |
黑色晶体 |
红棕色粉末 |
|
|
铁的价态 |
+2 |
+3 |
+2、+3 |
|
|
水溶性 |
难溶于水 |
|||
|
稳定性 |
不稳定性 6FeO+O2=2Fe3O4 |
稳定 |
稳定 |
|
|
与酸的反应 |
FeO+2H+=Fe2++H2O |
Fe2O3+6H+=2Fe3+ +3H2O |
Fe3O4+8H+=2Fe3++
Fe2++4H2O |
|
|
与CO的反应 |
FexOy+yCO=xFe+yCO2 |
|||
|
制取 |
高温熔融,过量的铁与氧气反应 2Fe+O2=2FeO |
Fe(OH)3的分解 2Fe(OH)3=Fe2O3 +3H2O |
铁在氧气中燃烧 3Fe+2O2=Fe3O4 |
|
4.炼钢
(1)设备:氧气顶吹转炉
(2)主要原料:炼钢生铁、生石灰、氧气。
(3)反应原理:利用氧化还原反应,在高温下,用氧化剂把生铁中过多的碳和其它杂质氧化为气体或炉渣除去。
(4)炼钢时的主要反应:
①氧化剂的生成,热能的来源 2Fe+O2 2FeO
2FeO
②降低碳的含量 C+FeO CO+Fe
CO+Fe
③除去S、P等杂质
④加硅铁、锰铁、铝除剩余FeO--脱氧
2FeO+Si 2Fe+SiO2
2Fe+SiO2
3.炼铁
(1)反应原理:利用氧化--还原反应,在高温下,用还原剂(主要是CO)把铁从铁矿石里还原出来。
(2)原料:铁矿石、焦炭、石灰石和空气
(3)设备:高炉
(4)生产过程
①还原剂的生成
C+O2 CO2 CO2+C
CO2 CO2+C
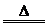 2CO
2CO
②铁矿石还原成铁
Fe2O3+3CO
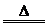 2Fe+3CO2↑
2Fe+3CO2↑
③除脉石、炉渣的形成
CaCO3 CaO+CO2↑
CaO+CO2↑
SiO2+CaO CaSiO3
CaSiO3
2.铁的合金
一般地说,含碳量在2%-4.3%的铁的合金叫做生铁。生铁里除含碳外,还含有硅、锰以及少量的硫、磷等,它可铸不可煅。根据碳的存在形式可分为炼钢生铁、铸造生铁和球墨铸铁等几种。
一般地说,含碳量在0.03%-2%的铁的合金叫做钢。钢坚硬有韧性、弹性,可以锻打、
压延,也可以铸造。
钢的分类方法很多,如果按化学成分分类,钢可以分为碳素钢和合金钢两大类。碳素钢就是普通的钢。合金钢也叫特种钢,是在碳素钢是适当地加入一种或几种,如锰、铬、镍、钨、铜等合金元素而制成的。合金元素使合金钢具有各种不同的特殊性能。
1.过渡元素位于周期表中中部从ⅢB-ⅡB族十个纵行,分属于第四周期至第七周期。过渡元素都是金属,又叫过渡金属。
过渡金属的密度一般比较大,熔沸点较高,有较高的硬度、较好的延展性和机械加工性能,较好的导电、导热性能和耐腐蚀性能。
过渡元素的原子最外层电子数不超过两个,在化学反应中,最外层和次外层都容易失去电子,因此过渡元素有可变化合价。所以当Fe与弱氧化剂反应时,只失去最外层上的2个电子,形成Fe2+;当Fe与强氧化剂反应时,还能进一步失去次外层上的一个电子,形成Fe3+。这就是铁在其化合物中通常显+2价或+3价的原因。则Fe发生化学反应能得到+2价还是+3价,需看参加反应的氧化剂的强弱,有时还要看反应物的量之间的关系。
例如:①铁在O2中燃烧的,一定要在集气瓶低留有少量的水或一层沙子,防止瓶子被炸裂;②Fe与S反应中Fe只能失去其最外层的2个电子而变成+2价,反应开始后撤去酒精灯,反应可以继续进行,说明反应放热;③Fe在Cl2中燃烧时不但能失去最外层的2个电子,而且还可失去次外层的1个电子后成+3价,说明氧化性Cl2>S;④在高温时能与C、P、Si等化合。
4.炼铁和炼钢的比较
|
|
炼铁 |
炼钢 |
|
原料 |
铁矿石、焦炭、石灰石、空气 |
生铁、空气(或纯氧、氧化铁)、生石灰、脱氧剂 |
|
化学原理 |
在高温下用还原剂从铁矿石里还原出来 |
在高温下用氧化剂把生铁里过多的碳和其它氧化为气体或炉清除去 |
|
主 要 反 应 |
①还原剂的生成 C+O2  CO2 CO2CO2+C  2CO 2CO②铁的还原 Fe2O3+3CO  2Fe+3CO2 2Fe+3CO2③炉渣的生成 CaCO3  CaO+CO2 CaO+CO2CaO+SiO2  CaSiO3 CaSiO3 |
①氧化:2Fe+O2 2FeO 2FeOFeO氧化铁水里的Si、Mn、C等。如C+FeO  Fe+CO Fe+CO ②造渣:生成的硅锰氧化物得铁水里的硫、磷跟造渣材料反应形成炉渣排出。 ③脱氧,并调整Mn、Si含量 2FeO+Si  2Fe+SiO2 2Fe+SiO2 |
|
主要设备 |
高炉 |
转炉 |
3.生铁与钢的比较
|
铁的合金 |
生铁 |
钢 |
|
含碳量 |
2%-4.3% |
0.03%-2% |
|
其它杂质 |
含硅、锰、硫、磷较多 |
含硅、锰少量,硫和磷几乎没有 |
|
机械性能 |
硬而脆、无韧性 |
硬而韧、有弹性 |
|
机械加工 |
可铸不可锻 |
可铸、可锻、可压延 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com