
20.(12分)
(1)
(2)
(3)
(4) (5)
(6)
19、(15分)
①
②
③
④
⑤
18、(8分)
(1) (2) (3) (4)
17、(10分) (1) (2)
(3)
(4) (只需填一个化学式) (5)
21、(7分)NaHCO3在潮湿的空气中会缓慢分解,Na2CO3会吸收空气中的水分:Na2CO3+nH2O=Na2CO3·nH2O(n为平均值,n≤10)。取没有妥善保管的NaHCO3样品A9.16g,溶于水配成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的CO2的体积(标准状况)如下表。(不计溶于水的CO2气体)
|
盐酸体积(mL) |
8 |
15 |
20 |
50 |
x |
120 |
150 |
|
生成CO2体积(mL) |
0 |
112 |
224 |
896 |
2240 |
2240 |
2240 |
试求:
(1)x的最小值为 。
(2)原样品中NaHCO3的质量。
(3)样品A中的成分及各成分的物质的量。
|
 2011届高三年级第二次月考化学试卷答题卡
2011届高三年级第二次月考化学试卷答题卡20.(12分)为研究温度对Cl2与KOH反应的影响,设计实验如下:
在蒸馏烧瓶中装入足量MnO2,分液漏斗中装足量浓盐酸,大试管A中装4mol/LKOH溶液15mL,并置于75℃水浴中,大试管B中装0.2mol/LKOH溶液,并置于冰水中,C中装NaOH溶液。
试回答下列问题:
(1)水浴加热有什么优点?
(2)如何判断A中已经反应完全?
(3)分离A中生成的两种盐,检测发现其中KCl为0.05mol(不考虑HCl挥发),写出A中发生的化学方程式
(4)分离B中生成的两种盐,其物质的量之比为1:1,写出离子方程式 。
(5)试管B要置于冰水中降温的主要原因是:
A.从试管A中出来的气体温度较高,易使试管B中的溶液温度升高
B.防止生成的盐分解 C.催化剂在冷水中活性最强
D.该反应是放热反应,为防止温度过高,采用降温
(6)图一中,分液漏斗下端连接玻璃管并伸入液面下,其作用是什么? 可以用图二代替吗? 。
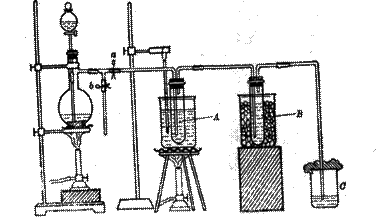

图一 图二
19、 (15分)已知M为氮元素与一种金属元素组成的离子化合物,其中金属元素的质量分数为35.4%,M在汽车安全气囊中有重要的作用。常温下G为淡黄色固体。H为一种常见的液体,A、B、C、X为单质,其中A、C、X为气体,A、X均为空气中成分。I、J为常见的工业原料。
(15分)已知M为氮元素与一种金属元素组成的离子化合物,其中金属元素的质量分数为35.4%,M在汽车安全气囊中有重要的作用。常温下G为淡黄色固体。H为一种常见的液体,A、B、C、X为单质,其中A、C、X为气体,A、X均为空气中成分。I、J为常见的工业原料。
①写出D与X反应的化学方程式
②写出G与H反应的离子方程式 。
③实验室中I应如何保存? 。
④常温下M受撞击时可分解,13gM完全分解为A和B时,放出akJ的热量,写出M分解的热化学方程式 。
⑤M是一种易溶于水的盐,其水溶液显弱碱性,用离子方程式解释原因 。
18、(8分)右图装置的用途多种多样,有“万能瓶”之称。
按下列要求回答问题:
(1)用该装置收集氢气,气体从 进入;(填A、B,下同)
收集一氧化氮,先将瓶子注满水,塞紧瓶塞,气体从 进入,
(2)用该装置除去混在氯气中的氯化氢,广口瓶应装 溶液,混合气从
进入;
(3)用该装置测量O2的体积时,将广口瓶注满水后,塞紧瓶塞,O2从 进入, 与带导管的量筒相接。
(4)医院里用盛蒸馏水的该装置连接氧气瓶与病人, 接氧气瓶, 与病人相接。
17、(10分)现有四种短周期元素X、Y、Z、W,其中:① X、W原子的电子层数与最外层电子数之比分别为3:1和 1:3 ② Y元素的某原子核内无中子 ③ Z元素原子的最外层电子数是其内层电子总数的2倍。回答下列问题:
(1)X元素在周期表中的位置是 。
(2)化合物X2W2的电子式是 。
(3) 向含1 mol Na2SiO3的溶液中缓慢通入2 mol的ZO2,反应的离子方程式是 。
(4)由Y、Z、W元素中的两种或三种可以组成多种分子,其中 含有18个电子的分子是 (只需填一个化学式)。
 (5)用KMnO4溶液可以通过滴定来测定Y2Z2W4溶液的物质的量浓度。向25.00
mL 的Y2Z2W4溶液中加入5.00 mL 0.50
mol/L酸性KMnO4溶液恰好完全反应,得到ZO2和Mn2+,则此种Y2Z2W4溶液的物质的量浓度是 mol/L。
(5)用KMnO4溶液可以通过滴定来测定Y2Z2W4溶液的物质的量浓度。向25.00
mL 的Y2Z2W4溶液中加入5.00 mL 0.50
mol/L酸性KMnO4溶液恰好完全反应,得到ZO2和Mn2+,则此种Y2Z2W4溶液的物质的量浓度是 mol/L。
16.将a mol钠和a mol铝一同投入m g足量的水中,所得溶液的密度为dg·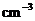 该溶液的质量分数为( )
该溶液的质量分数为( )
A.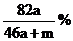 B.
B. C.
C. D.
D.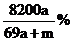
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com