
4. 一批产品抽50件测试,其净重介于13克与19克之间,将测试结果按如下方式分成六组:第一组,净重大于等于13克且小于14克;第二组,净重大于等于14克且小于15克;……第六组,净重大于等于18克且小于19克.如图是按上述分组方法得到的频率分布直方图.设净重小于17克的产品数占抽取数的百分比为
一批产品抽50件测试,其净重介于13克与19克之间,将测试结果按如下方式分成六组:第一组,净重大于等于13克且小于14克;第二组,净重大于等于14克且小于15克;……第六组,净重大于等于18克且小于19克.如图是按上述分组方法得到的频率分布直方图.设净重小于17克的产品数占抽取数的百分比为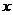 ,净重大于等于15克且小于17克的产品数为
,净重大于等于15克且小于17克的产品数为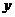 ,则从频率分布直方图中可分析出
,则从频率分布直方图中可分析出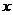 和
和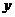 分别为( )
分别为( )
A. B.
B.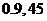
C. D.
D.
3.一袋中有大小相同的 个白球,
个白球,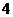 个黑球,从中任意取出
个黑球,从中任意取出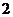 个球,取到颜色不同的球的概率是( )
个球,取到颜色不同的球的概率是( )
A. B.
B.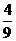 C.
C. D.
D.
2.二项式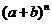 展开式中,奇数项系数和是
展开式中,奇数项系数和是 ,则
,则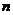 的值是( )
的值是( )
A.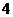 B.
B. C.
C.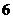 D.
D.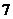
1.已知 ,则
,则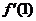 的值是( )
的值是( )
A.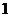 B.
B.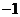 C.
C.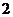 D.
D.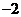
25.(11分)A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
|
阳离子 |
Ag+ Na+ |
|
阴离子 |
NO3- SO42- Cl- |
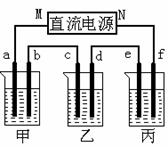
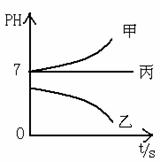 下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、 B、 C三种溶液,电极均为石墨电极。
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、 B、 C三种溶液,电极均为石墨电极。
接通电源,经过一段时间后,测得乙中C电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的_______极(填写“正”或“负”),甲、乙电解质分别为_______、_______(填写化学式)。
(2)计算电极f上生成的气体在标准状况下的体积_____________。
(3)写出乙烧杯的电解池总反应_____________________________。
(4)若电解后甲溶液的体积为25L,则该溶液的pH为___________ 。
(5)要使丙恢复到原来的状态,应加入 g 。(填写化学式)
24. (9分)某有机化合物A的结构简式如图回答下
(9分)某有机化合物A的结构简式如图回答下
列问题:
(1)A在 水溶液中加热得到B和C,C 是
水溶液中加热得到B和C,C 是
芳香族化合物,则C的结构简式是 。
(2)C酸化后可得F,F不能发生的反应类型是(填写字母代号) 。
a.取代反应 b.加成反应 c.消去反应
d.加聚反应 e.氧化反应 f.还原反应
(3)B与足量的某饱和一元羧酸D充分反应后生
成E,E和B的相对分子质量之差为84,则D的摩尔质量为 。
|
|

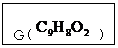





|
|
|
请写出:①H的结构简式 。 ②由F生成G的化学方程式 。
(5)符合下列三个条件的F的同分异构体的数目有多种,任写出其中一种的结构简式 。
①含有邻二取代苯环结构②与F具有相同的官能团 ③不与 溶液发生显反应
溶液发生显反应
23.(8分)具有水果香味的中性物质A可以发生下列变化:
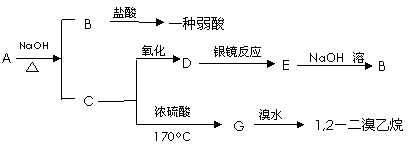
(1)推断下述物质的名称
A ___________、B _________。
(2)写出下列变化的化学方程式:
A与NaOH溶液反应 ___________________________________________ ;
D的银镜反应 _________________________________________________ 。
22. (9分)已知反应 ①、② 是化工生产中的两个重要反应:
(9分)已知反应 ①、② 是化工生产中的两个重要反应:
① 甲溶液 A + B + C
|
(1)A的电子式是 。
(2)将A通入B的溶液中,反应的离子方程式是 。
(3)1 g C在A中燃烧时放出92.3 kJ的热量,该反应的热化学方程式是 。
(4)工业上可利用E为原料冶炼其中所含的金属,方法是 。
 (5)将A和D按物质的量1:1通入下列装置中:
(5)将A和D按物质的量1:1通入下列装置中:
该过程中的化学方程式是 。
上述实验装置设计不完整,请将所缺部分在装置图的右边方框中画出。
(6)一定条件下,将12 g乙放入过量的的浓硝酸中,反应过程中转移1.5 mol电子,该反应的离子方程式是 。
21.(6分)有A、B、C、D、E五种短周期主族元素,原子序数按A、B、C、D、E顺序增大,A是半径最小的原子,B最外层电子数是次外层电子数的2倍,C2-与E+最外层电子数均为次外层的4倍,E和B 同主族。
(1)A、C、D三种元素形成的化合物的电子式_____________.
(2)BC2的电子式_____________.属_____________分子(填分子极性)。
EC2其固体属____________晶体。
(3)用电子式表示D2 C的形成过程_____________.
(4)B、C、D、E单质熔点由高到低的顺序为____________(填单质化学式)
20.(11分)已知某工业废水中含有CuCl2、FeCl2、HCl,某化学探究学习小组打算用这种废水制备纯净的FeCl2晶体。为此他们设计了如下的实验方案:
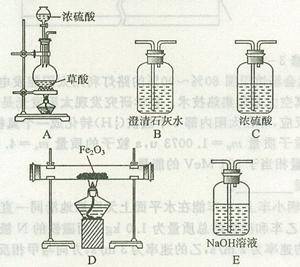
第一步:用上图中的仪器和药品组装一套实验装置制取干燥的CO,用CO还原Fe2O3粉末制取还原铁粉。提示:制取CO的原理为 。
。
(1)如果所制气体流向从左向右时,上述组装的实验装置从左向右的实验装置连接顺序(填仪器序号)是 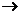
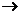
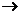
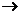 。
。
(2)正确的操作第一步应是 ;最后一步应是熄灭 处的酒精灯。
(3)装置B的作用是 ;装置E的作用是 。
(4)第二步:将制得的还原铁粉放入原混合溶液中,制得纯净的FeCl2溶液。
必须进行的操作是 。
(5)第三步:得到纯净的FeCl2晶体。
必须进行的操作是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com