
8.据报道,美国正在研究的新电池可能取代目前广泛使用的铅蓄电池,它具有容量大等优点,其电池反应为2Zn+O2===2ZnO,原料为锌粒、电解液和空气,则下列叙述正确的是
A.锌为正极,空气进入负极反应
B.负极反应为Zn-2e-===Zn2+
C.正极发生氧化反应
D.电解液肯定不是强酸
7.锂电池是新一代的高能电池,它以质轻、能高而受到普遍重视,目前已经研制成功了多种锂电池。某种锂电池的总反应可表示为:Li+MnO2===LiMnO2。若该电池提供5库仑(C)电量(其他损耗忽略不计),则消耗的正极材料的质量约为(式量Li:7;MnO2:87,电子电量取1.60×10-19C)
A.3.2×103 g B.7×10-4 g
C.4.52×10-3 g D.4.52×10-2 g
6.以下现象与电化腐蚀无关的是
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈
D.银制奖牌久置后表面变暗
5.生物体中细胞膜内的葡萄糖,细胞膜外的富氧液体及细胞膜构成微型的生物原电池,下列有关判断正确的是
A.负极发生的电极反应可能是: O2-4e-+2H2O===4OH-
B.正极发生的电极反应可能是: O2-4e-===2O2-
C.负极反应主要是C6H12O6生成CO2或HCO
D.正极反应主要是C6H12O6生成CO2或CO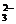
4.某原电池总反应的离子方程式为2Fe3++Fe===3Fe2+,不能实现该反应的原电池组成是
A.正极为铜,负极为铁,电解质溶液为FeCl3溶液
B.正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液
C.正极为铁,负极为锌,电解质溶液为Fe2(SO4)3溶液
D.正极为银,负极为铁,电解质溶液为CuSO4溶液
3.铁棒与石墨棒用导线连接后浸入0.01 mol·L-1的食盐溶液中,可能出现的现象是
A.铁棒附近产生OH- B.铁棒被腐蚀
C.石墨棒上放出Cl2 D.石墨棒上放出O2
2.(2000年上海高考题)随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子污染土壤和水源
C.不使电池中渗出的电解液腐蚀其他物品
D.回收其中的石墨电极
1.(2003年春季高考理综题)家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是
A.4Fe(OH)2+2H2O+O2===4Fe(OH)3↓
B.2Fe+2H2O+O2===2Fe(OH)2↓
C.2H2O+O2+4e-===4OH-
D.Fe-3e-===Fe3+
4、计算技巧
(1)差量法
[例]在一个固定体积的密闭容器中,放入2molX和3molY,在一定条件下反应:4X(气)+3Y(气)  2Q(气)+nR(气)达到平衡后,容器内温度不变,容器内压强比原来增加5%,X的浓度减小1/3,则反应方程中的n值为( C ) A、5 B、3 C、6
D、2
2Q(气)+nR(气)达到平衡后,容器内温度不变,容器内压强比原来增加5%,X的浓度减小1/3,则反应方程中的n值为( C ) A、5 B、3 C、6
D、2
解析:由题意可知反应向右进行,并且气体物质的量增大,则右边气体系数大,故2+n>4+3,n>5,大于5的只有6,故选C
(2)极限法
[例]在一定温度下的密闭容器中加入CO和H2O(气)各1mol当反应
CO+H2O(气) CO2+H2 达到平衡时生成0.5mol的CO2,若其它条件不变,再充入8molH2O(气)重新达到平衡时CO2的物质的量为
( B )
CO2+H2 达到平衡时生成0.5mol的CO2,若其它条件不变,再充入8molH2O(气)重新达到平衡时CO2的物质的量为
( B )
A、0.5mol B、0.93mol C、1mol D、1.5mol
解析:增加H2O的量,平衡右移,CO2必定增多,CO的转化率必定增大,之于增多大,无法判断,故CO的总转化量范围是0.5<CO<1,
故CO2范围是0.5<CO2<1,在其范围的都符合,故选B
(3)守恒法
[例]将1molA、2molB的混合物132g在密闭容器中反应:
A(气)+2B(气) 2C(气)+2D(气)达到平衡后,测得A的转化率为30%,则平衡时混合气体的平均分子量为( C )
2C(气)+2D(气)达到平衡后,测得A的转化率为30%,则平衡时混合气体的平均分子量为( C )
A、44 B、48 C、40 D、52
解析:因为反应前后均为气体,故气体质量始终不变,又因为反应向右进行,故气体物质的量必定增多,摩尔质量必定减小,不转化时平均摩尔质量是44,故应小于44,所以选C
3、反应物转化率与浓度的关系
⑴对于多种物质参加的反应(气、液态)
m A (g) +n B (g)  p C (g) +q D (g)
p C (g) +q D (g)
反应达到平衡后,C( A )↑ ,B的转化率可提高,但A的转化率一般降低; C (B) ↑ ,A的转化率可提高,但B 的转化率一般降低。
m +n > p +q :恒容同时按原比例增加A、B的量,A、B的转化率都增大。
恒压同时按原比例增加A、B的量,A、B的转化率不变
m +n< p +q :恒容同时按原比例增加A、B的量,A、B的转化率都减小。
恒压同时按原比例增加A、B的量,A、B的转化率不变
m +n= p +q :不论恒容还是恒压,同时按原比例增加A、B的量,A、B的转化率都不变。
⑵对于分解反应,要视反应前后物质的化学计量数而定
m A(g)  n B(g) + p C(g)
n B(g) + p C(g)
m = n + p:不论如何改变反应物的浓度,反应物的转化率都不变。
m < n +p:增加反应物的浓度时,反应物的转化率减小。
m > n+ p:增加反应物的浓度时,反应物的转化率增大。
对于两端都只有一种物质的反应,恒容条件下,不管加那端的物质,百分含量和转化率都用加压平衡向气体系数小的方向移动去分析。
例:2NO2 N2O4反应达到平衡后,不管加谁,若恒温恒容反应,达新平衡后,NO2百分含量减小,N2O4百分含量增大。
N2O4反应达到平衡后,不管加谁,若恒温恒容反应,达新平衡后,NO2百分含量减小,N2O4百分含量增大。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com